ІОНООБМІННІ МАТЕРІАЛИ І ЇХ ХАРАКТЕРИСТИКИ
Всі відомі іонообмінні матеріали за хімічним складом можна розділити на дві групи: мінеральні й органічні. Мінеральні іоніти практично не застосовуються на ТЕС через малу ємність|місткості| поглинання і здатності до розкладання в кислому середовищі|середовищі| з|із| виділенням кремнієвої| кислоти.
В наш час|нині| на ТЕС в основному знаходять|находять| застосування лише спеціально синтезовані іоніти органічного походження|. При синтезі іонітів необхідно створити матрицю і ввести|запроваджувати| в неї функціональні групи. Є|наявний| декілька шляхів|доріг| для цього, але|та| в основному це здійснюється введенням|вступом| функціональних груп в молекули якої-небудь нерозчинної у воді органічної речовини, що мають, або отриманням|здобуттям| практично нерозчинної речовини з|із| подальшим|наступним| введенням|вступом| в її молекулу функціональних груп. За першим шляхом|дорозі| синтезу отримують|одержують| різні марки сульфовугілля|. Для цього фракціоноване вугілля (бурий, антрацит) обробляють сірчаною кислотою. При цьому відбуваються|походять| процеси гуміфікації| з|із| утворенням карбоксильних груп і сульфування з|із| утворенням сульфогруп|.
Але|та| основний напрям|направлення| синтезу полягає в отриманні|здобутті| іонітів на основі штучних смол. Матриця такого іоніту є просторовою сітчастою структурою з|із| вуглеводневих ланцюгів|цепів|, яка може бути отримана|одержувати| поліконденсацією| або полімеризацією. Останніми роками все частіше використовують полімеризаційні смоли, отримані|одержувати| на основі стиролу. При полімеризації стиролу утворюється лінійний полімер, який «зшивається» молекулами дивинилбензола| з|із| утворенням тривимірної|трьохмірної| структури:

де номером 1 позначені молекули стиролу, а номером 2 – молекули дивинилбензола. Така структура володіє відомим ступенем еластичності і здатністю змінювати свій об'єм (набухати) у воді. У строгому розумінні пор в тілі такого полімеру немає, але їх аналогом можуть служити відстані між зшиванням і ланцюгами набряклого полімеру (3 нм). Проте для спеціальних цілей в наш час виготовляються макропористі іоніти з радіусом пір від 8 до 2 · 104 нм.
Функціональні групи, які додають матеріалу смоли іонообмінні властивості, приєднуються до бензолових ядер, заміщають в них атоми водню. Групи, що додають іонітам властивості катіонітів: –SO3H (сульфогруппа), –СООН (карбоксильна) і –ОН (фенолова). При контакті з водою функціональні групи катіонітів дисоціюють з відщеплюванням іонів водню, які утворюють дифузний шар. Монофункціональні катіоніти, що містять сульфогрупи, є сильнокислотними, а що містять карбоксильні групи – слабокислотними. Є також поліфункціональні катіоніти, що містять обидві групи (наприклад, сульфовугілля). Характер групи істотно впливає на обмінну ємність катіоніту залежно від рН. Сильнокислотні катіоніти здійснюють обмін іонів в широкій області значень рН, тоді як слабокислотні в кислій області різко зменшують здібність іонів до обміну (зменшується ступінь дисоціації функціональних груп).
Функціональними групами, що додають матеріалу смоли аніонообмінні властивості, є різні аміногрупи ( ≡N, =NH, –NH2) і групи чотирьохзаміщеного амонія (–NR3OH). При приєднанні перших трьох груп утворюються слабоосновні аніоніти, а група –NR3OH додає аніоніту сильноосновний характер. Аміногрупи сорбують іони водню з утворенням комплексів –NH3+, =NH2+ (потенціалутворюючих іонів) і подальшим утворенням дифузного шару. Група –NR3OH дисоціює з переходом іона ОН– в дифузний шар. Слабоосновні аніоніти успішно здійснюють іонний обмін лише в кислому середовищі, тоді як у високоосновних обмін аніонів відбувається в широкій області значень рН.
Якість іонітів визначається лавою фізико-хімічних і технологічних властивостей, найважливішими з яких є фракційний склад, насипна щільність, хімічна стійкість, механічна міцність, обмінна ємність, кислотність або основність.
У технології іонного обміну застосовуються іоніти з діаметром зерен 0,3 – 2 мм. Коефіцієнт неоднорідності фракції іоніту, що засипається у фільтр, не повинен перевищувати 2 аналогічно умовам засипки механічних фільтрів. У вологому стані іоніти набухають і збільшують свій об'єм, що слід враховувати при заповненні фільтрів. Ступінь набухання визначається коефіцієнтом Кн,значенняякого залежить від матеріалу іоніту, іонної форми, рН і інших чинників і складає 1,05 – 2.
При експлуатації іоніти піддаються механічним навантаженням| (здавленню, тертю), тому вони частково истираются|, підвищується концентрація дрібних|мілких| часток|частинок| і внаслідок цього зростає гідравлічний опір фільтруючого шару. Тому до іонітів пред'являється вимога достатньої механічної міцності, яка задається через коефіцієнт истираемости, що визначається як втрата маси %/год. Механічно міцні іоніти повинні мати коефіцієнт истираемости не більше 0,5% /год.
Хімічна стійкість іонітів виражається в їх здатності протистояти розчинювальній(растворяющему) дії води і її домішок. Під дією середовища може також відбуватися пептизація іонітів, тобто перехід їх в колоїдний розчин. Хімічна стійкість іонітів залежить від рН середовища, природи і концентрації розчинених в ній іонів і, що особливо важливе, від температури, з підвищенням якої стійкість знижується. Ця обставина є основною перешкодою, що не дозволяє підвищувати температуру на іонообмінних фільтрах більше 313 К.
Обмінна ємність є найважливішою технологічною характеристикою іонітів. Вона виражається кількістю іонів, поглинених одиницею маси (г-екв/кг) або одиницею об'єму (г-екв/м3) іоніту. Розрізняють повну обмінну ємність, ємність «до проскакування» і робочу. Обмінна ємність, визначена у момент вирівнювання концентрації іона, що поглинається, у воді і фільтраті, називається повною. Якщо фільтрування закінчується у момент проскакування іона (концентрація його у фільтраті близька до нульової), що поглинається, то обмінна ємність іоніту визначається як ємність «до проскакування». Проте в експлуатації фільтрування часто припиняється в мить, коли концентрація певного іона, що поглинається, у фільтраті складає деяке (вельми мале) значення. В цьому випадку обмінна ємність іоніту визначається як робоча, яка найчастіше настільки мало відрізняється від ємності «до проскакування», що їх можна приймати рівними одна одній. Обмінна ємність залежить від багатьох чинників, у тому числі від умов регенерації, іонної форми, природи іонів, що поглинаються, значення рН води, швидкості потоку води, геометричних характеристик шару. Характеристики деяких іонітів, що застосовуються в схемах ВПУ, приведені в таблиці. 3.1.
Таблиця 3.1. Характеристика деяких іонітів, що застосовуються в схемах ВПУ
| Марка іоніту | Країна-виробник | Функці- ональна група | Фракція, мм | Кн | Робоча ємність Ер, г-екв/м3 | ||
| при Н-каті-онуванні | при Na-ка-тіонуванні | при ОН-аніонуванні | |||||
| Катіоніти Сульфовугілля СМ-1 КУ-2 КБ-4 Вофатіт Р Амберлайт IRA-100| Аніоніти АН-31 АВ-17 Амберлайт IRA-400 | СРСР ГДР США СРСР СРСР США | - SO3H -СООН -ОН - SO3H -СООН - SO3H -ОН - SO3H -ОН ≡N, =N2 –NR3 –NR3 | 0,3—0,8 0,3—1,0 0,3—0,75 0,3—1,0 0,3—0,8 0,2—0,85 0,3—0,85 | 1,2 1,42 1,24 1,45 2,0 1,9 1,58 | – – – – | – – – | – – – – – |
Процес іонного обміну має циклічний характер. Після виснаження іоніту потрібне відновлення його обмінної властивості – регенерація, при якій використовується оборотність процесу обміну іонів. Для цього через виснажений шар іоніту пропускається регенераційний розчин, що містить первинні обмінні іони. Розглянемо рівняння балансу при видаленні домішки з води (2.98). У цьому рівнянні величина q є кількістю домішки, що уловлюється одиницею об'єму шару. Оскільки шар складається із зерен іоніту і рідини, що знаходиться в проміжках між зернами, можна записати, що
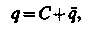
| (3.5) |
де С і 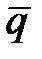 – відповіднокількість домішок в рідкій і твердій частках одиниці об'єму шару.
– відповіднокількість домішок в рідкій і твердій частках одиниці об'єму шару.
Це дає можливість|спроможність| записати (2.98) у вигляді

| (3.6) |
де υ – швидкістьпотоку води;
х – координатависоти шару;
τ – час.
Це рівняння записане для випадку, коли 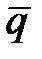 і С вимірюються в однакових одиницях: еквівалентах, віднесених до одиниці об'єму шару. Зазвичай С вимірюють в еквівалентах, віднесених до одиниці об'єму рідкої фази. Для переходу від одних одиниць виміру до інших використовують величину пористості ε. З врахуванням цього рівняння (3.6) матиме вигляд
і С вимірюються в однакових одиницях: еквівалентах, віднесених до одиниці об'єму шару. Зазвичай С вимірюють в еквівалентах, віднесених до одиниці об'єму рідкої фази. Для переходу від одних одиниць виміру до інших використовують величину пористості ε. З врахуванням цього рівняння (3.6) матиме вигляд

| (3.7) |
Для повного|цілковитого| опису процесу іонного обміну в загальному випадку необхідні ще два рівняння: рівняння кінетики і рівняння ізотерми обміну іонів. Проте|однак| для опису процесу регенерації при швидкостях потоку води 5 – 10 м/год. рівнянням кінетики можна нехтувати, оскільки при таких швидкостях рівновага між розчином і іонітом досягається досить|достатньо| швидко. Тоді система рівнянь, що описують процес регенерації, буде
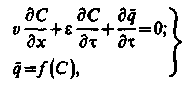
| (3.8) |
де друге рівняння представляє|уявляє| рівняння ізотерми іонного обміну.
Візьмемо часткову похідну за часом для ізотерми сорбції

| (3.9) |
де  є f’(С) – похідна від ізотерми сорбції.
є f’(С) – похідна від ізотерми сорбції.
Підставивши її значення в (3.7), отримаємо
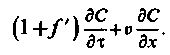
| (3.10) |
Прийнявши в цьому рівнянні
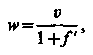
| (3.11) |
можемо записати систему рівнянь (3.8) для 1-го іона у вигляді
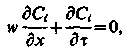
| (3.12) |
де w – швидкістьпереміщення концентраційних точок фронту рухомої домішки, яка залежить від виду ізотерми сорбції.
У нашому випадку значення w представлене у вигляді
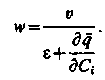
| (3.13) |
Можна показати, що єдиним розв’язанням (3.12) за умови 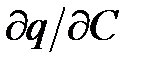 <0(увігнута ізотерма, характерна для всіх умов процесу регенерації) буде
<0(увігнута ізотерма, характерна для всіх умов процесу регенерації) буде
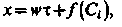
| (3.14) |
в якому f(Cі) є початковим розподілом іонів перед процесом регенерації. Якщо цей розподіл в порівнянні зі шляхом, минувшим його фронтом, малий, то з (3.13) і (3.14) витікає, що
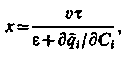
| (3.15) |
де х – висота шару іоніту.
Для отримання розрахункового рівняння регенерації скористаємося ізотермою обміну одновалентних іонів: і-го в розчині і j-гo в іоніті:

| (3.16) |
де kі, j – константа масообміну між іонами і та jв розчині й іоніті;
qо і Со – початкові концентрації іонів в розчині і іоніті;
Сі і qі – поточні концентрації іонів в розчині і іоніті, звідки
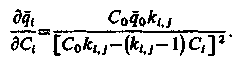
| (3.17) |
Підставляючи це рівняння в (3.15), заздалегідь помноживши праву і ліву частини останнього на площу перетину фільтру F, отримуємо

| (3.18) |
де Vо – об'єм іоніту в шарі;
Vp – об’ємрегенераційного розчину, який пропущений через шар, до моменту появи у фільтраті концентрації регенеруючого іона і, рівної Сі.
Зазвичай це рівняння записують|занотовують| в зручнішому вигляді|виді|:
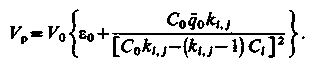
| (3.19) |
Введемо поняття відносної концентрації i-го іона φ = Ci /Cо і розподільного відношення h = 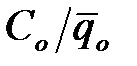 .Тоді (3.19) запишеться у вигляді
.Тоді (3.19) запишеться у вигляді
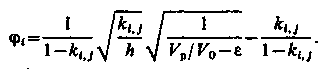
| (3.20) |

Рис. 3.4. До розрахунку регенерації іонітного фільтру
На рис. 3.4 показана залежність φі(Vр), що відповідає (3.20). З графіка цього рисунка видно, що φі стає відмінним від 0 при деякому значенні 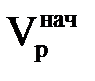 , а рівним одиниці при значенні
, а рівним одиниці при значенні 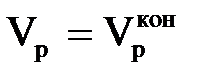 . Якщо рахунок значень вести від φі =1 до 0, то отримаємо φj = 1 – φі. З цього рівняння виходить, що j-им іоном є іон, що вимивається з іоніту. Таким чином, площа під кривою φі(Vр) в інтервалі значень φі від 0 до 1 є не що інше, як кількість регенеруючого іона, що виходить з фільтру при пропусканні регенераційного розчину об'ємом
. Якщо рахунок значень вести від φі =1 до 0, то отримаємо φj = 1 – φі. З цього рівняння виходить, що j-им іоном є іон, що вимивається з іоніту. Таким чином, площа під кривою φі(Vр) в інтервалі значень φі від 0 до 1 є не що інше, як кількість регенеруючого іона, що виходить з фільтру при пропусканні регенераційного розчину об'ємом 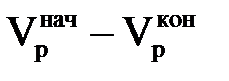 . В той же час площа фігури
. В той же час площа фігури 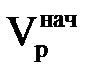 A1L відповідає кількості іоніту j, що витісняється з шару. Отже, кількість іона j, що залишився в іоніті, визначатиметься виразом
A1L відповідає кількості іоніту j, що витісняється з шару. Отже, кількість іона j, що залишився в іоніті, визначатиметься виразом
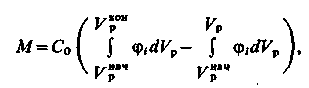
| (3.21) |
де перший інтеграл – це спільна кількість іона j,що вимивається з шару іоніту, при 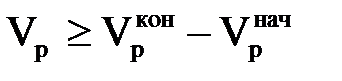 , а другий – кількість іона j,що вимивається з шару іоніту, при пропусканні регенераційного розчину в кількості Vр і лежачого в інтервалі значень
, а другий – кількість іона j,що вимивається з шару іоніту, при пропусканні регенераційного розчину в кількості Vр і лежачого в інтервалі значень 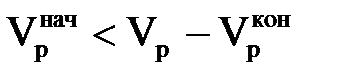 . Цей вираз можна переписати у вигляді
. Цей вираз можна переписати у вигляді
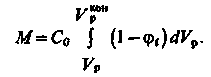
| (3.22) |
Підставляючи в (3.22) значення φі по (3.20) і віднімаючи з (3.19) значення Vр за умови Cі = Co (φі = 1). після інтеграції отримуємо

| (3.23) |
Концентрація іона j, що витісняється, в шарі іоніту після пропускання регенераційного розчину в об'ємі, рівному Vp, визначається рівнянням
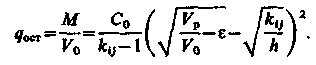
| (3.24) |
Звідси витікає, що рівняння неповної регенерації іоніту, що визначає концентрацію відрегенерованих функціональних груп в шарі іоніту, матиме вигляд

| (3.25) |
Значення q'о підставляється в рівняння стадії роботи іонітних фільтрів (3.38) і (3.52). Рівняння (3.25) отримане в МЕІ А.А. Громогласовим.
Розрахунок стадії регенерації реальних іонітних фільтрів можна з достатнім ступенем наближення проводити по рівнянню для q'o, яке в даному випадку буде справедливе в обмеженому інтервалі значень Vр, причому kij тоді втрачає фізичний сенс і стає емпіричною величиною.
Дата добавления: 2015-05-19; просмотров: 2113;
