ТЕХНОЛОГІЯ ІОННОГО ОБМІНУ
У технології водопідготовки для видалення|віддалення| певних іонів з|із| води застосовують два процеси: те, катіонування – видалення|віддалення| катіонів і аніонування – видалення аніонів. Залежно від обмінного|змінного| іона процеси і апарати отримують|одержують| назви: Н-катіонування|, Н-катіонітний фільтр; ОН-аніонування, ОН-аніонітний фільтр і т.п. Відповідно називається і фільтрат, отриманий|одержувати| в цих процесах: Н-катіонована| вода; ОН-аніонована вода і т.п. Процеси катіонування води можуть мати цілком|сповна| самостійне значення (для зм'якшування води), тоді як процеси аніонування застосовуються лише в комплексі з|із| катіонуванням (у схемах знесолення води). Процеси іонування здійснюють в різних апаратах, але|та| найбільше поширення|розповсюдження| набули насипні іонітні фільтри.
Na-катіонування.Цей процес застосовується для зм'якшування води і має самостійне значення при підготовці води малої лужності для котлів низького тиску і підживлення води тепломереж. При Na-катіонуванні воду пропускають через шар катіоніту, що знаходиться в початковому стані в Na-формі. При цьому процесі відбувається видалення з води іонів Са2+ і Mg2+ в обмін на еквівалентну кількість іонів Na+ згідно наступним реакціям:
| 2R/Na+ + Ca2+ ⇄R2/Ca2+ + 2Na+; | (3.26) |
| 2R/Na+ + Mg2+ ⇄R2/Mg2+ + 2Na+, | (3.27) |
де R позначає комплекс матриці і функціональної групи без обмінного іона (його прийнято вважати одновалентним).
З наведених реакцій видно, що аніонний склад води при Na-катіонуванні залишається постійним, тому і сумарна концентрація катіонів, що беруть участь в цьому процесі, також залишається постійною. Проте масова концентрація катіонів в розчині декілька зростає, оскільки еквівалентна маса іона натрію вища за еквівалентні маси іонів кальцію і магнію. Так, при обміні іонів Са2+ на іони Na+ солевміст води зростає у 46/40 разів, оскільки замість одного сорбованого іона Са2+ в розчин поступають два іони Na+. Той же перерахунок при сорбції іонів магнію дасть збільшення солевмісту у 46/24 разів.
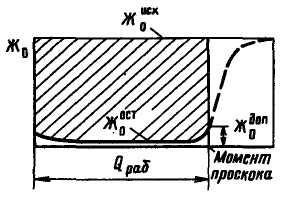
Рис. 3.5. Вихідна крива Na-катіонітного фільтру
Таким чином, солевміст Na-катіонованої води декілька вище за солевміст початкової. Оскільки при Na-катіонуванні не відбувається зміни аніонного складу домішок води, лужність її не змінюється. Залишкова жорсткість фільтрату визначається умовам регенерації катіоніту і в кращому разі складає не більше 5 мкг-екв/кг. Процес зм'якшування при Na-катіонуванні закінчується при допустимому значенні жорсткості фільтрату або при настанні проскакування жорсткості. Характер зміни якості фільтрату показаний на рис. 3.5, з якого видно, що площа, обмежена вихідною кривою, початковою жорсткістю 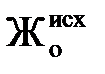 і кількістю води Qраб за робочий цикл, виражає робочу обмінну ємність всього об'єму катіоніту Vкат,що знаходиться у фільтрі. Робочу обмінну ємність Ер, г-екв/м3, катіоніту можна визначити (при Жост = 0) так:
і кількістю води Qраб за робочий цикл, виражає робочу обмінну ємність всього об'єму катіоніту Vкат,що знаходиться у фільтрі. Робочу обмінну ємність Ер, г-екв/м3, катіоніту можна визначити (при Жост = 0) так:
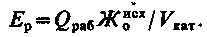
| (3.28) |
З|із| рис. 3.5 видно|показний| також, що робоча обмінна|змінна| ємність|місткість| істотно|суттєвий| залежить від вигляду|виду| вихідний кривої Na-катіонітного| фільтру, тобто від гостроти фронту фільтрування.
Регенерація виснаженого катіоніту| проводиться|виробляє| пропусканням| через нього розчину куховарської|кухонної| солі|соль|. Реакцію регенерації катіоніту розчином NaCl| можна записати в наступній|слідуючій| формі:
| 2R/Сa2+ + nNa+ ⇄2R/Na+ + Ca2+ + (n – 2)Na+; | (3.29) |
| 2R/Mg2+ + nNa+ ⇄2R/Na+ + Mg2+ + (n – 2)Na+, | (3.30) |
де n – надлишок NaCl проти його стехіометричної кількості.
Оскільки для регенерації використовують технічні реагенти, що містять сторонні домішки (у нашому випадку Са2+ і Mg2+), то добре відрегенерувати фільтр не удається. Крім того, якість регенерації істотно залежить від прояву так званого протиіонного ефекту. При обмеженій витраті солі на регенерацію краще будуть відрегенеровані ділянки шару катіоніту, що зустрічаються зі свіжим розчином. У міру проходження розчину вглиб шару умови регенерації погіршуватимуться внаслідок підвищення концентрації іонів Са2+ і Mg2+ в регенераційному розчині і його збіднення за іонами Na+. Це явище носить назву протиіонного ефекту. Такий ефект виникає і в процесі зм'якшування початкової води. Регенерацію іоніту можна проводити декількома способами, які відрізняються один від одного поєднанням напряму потоку регенераційного розчину і води.
Якщо регенераційний розчин минає шар іоніту в тому ж напрямі, що і потік води, то це прямотічна регенерація. Така регенерація створює невигідні умови для процесу зм'якшування, оскільки при цьому особливо добре регенерується перша по ходу води верхня ділянка шару і погано нижній шар іоніту (рис. 3.6, а), тому на виході з шару катіоніту зм'якшувана вода, в якій різко знижена концентрація іонів жорсткості, проходить через ділянки погано відрегенерованого катіоніту і, отже, не може глибоко зм'якшуватися. Більш того, ця обставина може привести на початку циклу навіть до переходу деякої частини іонів жорсткості з катіоніту у воду.|направленню|
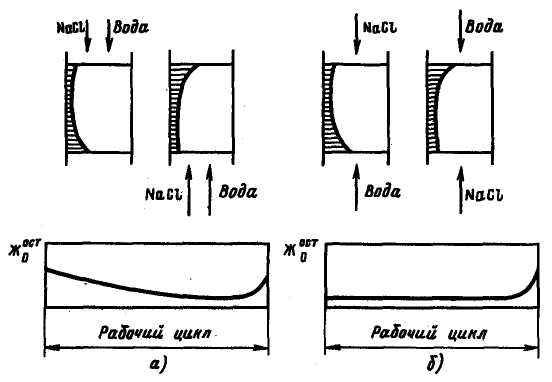
Рис 3.6. Характер зміни залишкових концентрації іонів Са2+ і Mg2+ в шарі катіоніту і залишковій жорсткості фільтрату при прямотічній (а) і протитічній (б) регенерації
При протитічній регенерації регенераційний розчин подається в напрямі|направленні|, протилежному напряму потоку води (рис. 3.6,б). При цьому свіжий регенераційний розчин добре регенерує нижній шар іоніту, що дозволяє, з одного боку, зберігати постійне значення залишкової концентрації іонів у фільтраті, а з|із| іншого, отримувати|одержувати| фільтрат вищої якості. Крім того, застосування протитічної регенерації дозволяє економити реагенти. Проте|однак| цей вид регенерації пов'язаний з ускладненням конструкції фільтрів.
Для підвищення якості зм'якшування застосовують двохступінчасту| схему Na-катіонування|, тобто послідовне включення| двох фільтрів. При цьому регенерацію їх проводять роздільно прямотоком|. Фільтр першого ступеня|рівня| регенерується з|із| питомою витратою NaCl|, рівною 1,8 – 2,4, а другого ступеня – з| витратою 6,5 – 7,5 г-екв/г-екв іонів жорсткості, що видаляються|віддаляють|. Така схема дозволяє мати залишкову жорсткість води після|потім| фільтру першого ступеня|рівня| 20 – 100, а після|потім| фільтру другого ступеня – менше| 5 мкг-екв/кг. Питома витрата солі|соль| при одноступінчатому Na-катіонуванні складає 3 – 6 г-екв/г-екв. Двохступінчаста схема дозволяє економити NaCl| при кращій якості фільтрату і понизити|знизити| витрату води на власні потреби|нужду|. Регенерація проводиться|виробляє| 8 – 10 %-им| розчином NaCl|. Розчин пропускається через фільтр зі|із| швидкістю близько 1,5·10–3 м/с.
Н-катіонування.Призначенням Н-катіонування є видалення всіх катіонів з води із заміною їх на іони водню. Воно застосовується в схемах спільно з іншими процесами іонування. Обмін катіонів при Н-катіонуванні протікає згідно реакціям
| 2R/Н+ + Ca2+ ⇄R2/Ca2+ + 2Н+; | (3.31) |
| 2R/Н+ + Mg2+ ⇄R2/Mg2+ + 2Н+; | (3.32) |
| R/Н+ + Na+ ⇄R/Na+ + Н+, | (3.33) |
Всі катіони, що поступають разом з водою на фільтруючий шар, сорбуються на початку процесу у верхніх ділянках цього шару. Проте у міру спрацьовування частини шару катіони, що володіють більшою селективністю, витісняють сорбовані на цій ділянці катіони, що володіють меншою сорбціонною здатністю, і останні сорбуються на подальших по ходу води ділянках фільтруючого шару. Таким чином, утворюються зони поглинання катіонів. Ближче до нижньої межі шару розташовується зона поглинання іонів Na+, над нею – змішана зона поглинання Mg2+ і Na+, а ще вище – зона поглинання Са2+, Mg2+ і Na+. Сумарна ширина цих зон визначає висоту робочої зони катіоніту. Над нею розташовується зона виснаженого катіоніту, а під нею – свіжого катіоніту. При роботі Н-катіонітного фільтру спостерігаються два періоди (рис. 3.7). У першому періоді відбувається повне
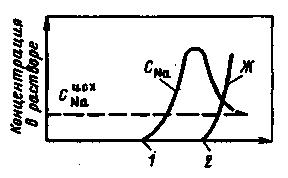
Рис. 3.7. Зміна якості фільтрату при Н-катіонуванні:
1– проскакування Na; 2 – проскакуванняжорсткості
поглинання всіх катіонів до моменту досягнення зоною поглинання іонів Na+ нижньої межі шару катіоніту (до проскакування Na+). До цього моменту на кожен еквівалент поглинених з розчину іонів Са2+, Mg2+ і Na+ в розчин поступає один еквівалент іонів Н+. Іони водню, що виділяються у воду, реагують з бікарбонат-іоном:
| Н+ + НСО3– ⇄ Н2СО3 ⇄СО2 + Н2О. | (3.34) |
Таким чином, при Н-катіонуванні одночасно з основним процесом відбувається руйнування бікарбонатної лужності води. Фільтрат набуває кислотності, рівної залишковій концентрації іонів Н+.
Другий період характеризується часом після проскакування іонів Na+ у воду. У цей період Н-катіонування поступово припиняється і починається витіснення іонами жорсткості раніше поглинених іонів Na+ у воду, тобто процес Н-катіонування переходить в Na-катіонування. У міру зростання концентрації іонів Na+ у фільтраті зростає лужність води і у момент досягнення концентрації іонів Na+ у фільтраті, рівної початковій, лужність відновлюється повністю. Концентрація іонів Na+ у фільтраті потім стає більше початкової, оскільки його іони, що витісняються, приєднуються до іонів Na+ в початковій воді, і потім поступово наближається до початкової концентрації іонів Na+ у міру наближення проскакування іонів жорсткості (Mg2+). Таким чином, при Н-катіонуванні спостерігаються два проскакування іонів, що супроводжуються різкою зміною лужності і кислотності води.
Робота фільтру до проскакування іонів Na+ або іонів жорсткості залежить від технологічної схеми його використання. Відповідно змінюється і робоча обмінна ємність катіоніту при роботі до проскакування того або іншого іона.
Регенерація Н-катіонітного фільтру проводиться|виробляє| 1–1,5 %-им| розчином сірчаної кислоти, як дешевшою і зручнішою в експлуатації, згідно|згідно з| реакціям
| R2/Ca2+ + nН+ ⇄2R/Н+ + Ca2+ + (n – 2)H+; | (3.35) |
| R2/Mg2+ + nН+ ⇄2R/Н+ + Mg2+ + (n – 2)H+; | (3.36) |
| R/Na+ + nН+ ⇄R/Н+ + Na+ + (n – 1)H+, | (3.37) |
Серйозним обмеженням при регенерації сірчаною кислотою є можливе загипсовывание катіоніту в результаті утворення CaSO4. Ця обставина примушує обмежувати міцність регенераційного розчину або здійснювати двохступінчасту регенерацію. В цьому випадку регенерація проводиться спочатку 0,75 %-им розчином кислоти, а потім, коли основна маса іонів вже витиснена, 5 – 6 %-им розчином кислоти. Проте така схема регенерації створює відомі незручності при експлуатації. Іншим заходом для запобігання випаданню гіпсу є обмеження часу контакту регенераційного розчину з катіонітом.
Істотно|суттєвий| знижується витрата реагенту при застосуванні протитічної регенерації Н-катіонітних фільтрів (рис. 3.8). В цьому випадку розчин кислоти концентрацією 0,75 – 1,0% пропускається в напрямі|направленні|, протилежному потоку води, і відводиться через дренажну систему, розташовану|схильну| нижче за верхню межу шару на 0,2 – 0,5 м. Відмивання ведуть у тому ж напрямі|направленні|, що і пропускання кислоти, причому відмивання слідує|прямує| відразу ж за пропусканням регенераційного розчину з метою швидкої евакуації цього розчину з|із| фільтруючого шару. Потім проводять|виробляють| розпушування верхньої частини|частини| шару. Ця частина|частина| шару не піддається регенерації і не бере участь в процесі іонного обміну. Її роль зводиться до утримання тієї невеликої частини|частини| грубодисперсних речовин, які можуть потрапити на Н-катіонітний фільтр з|із| освітленою водою.
Протиіонний ефект помітно виявляється при Н-катіонуванні вод із значним вмістом іонів SO4 і Сl. Більш того, при Н-катіонуванні таких вод на слабокислотних катіонітах унаслідок різкого пониження значення рН
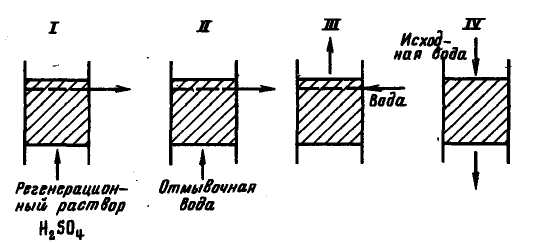
Рис. 3.8. Технологічна схема протитічної регенерації Н-катіонітних фільтрів:
I – пропускання розчину кислоти; II – відмивання; III – розпушування верхнього шару; IV – робочий цикл
знижується обмінна ємність цих катіонітів за рахунок придушення дисоціації таких груп, як –СООН і –ОН.
Конструктивні труднощі в здійсненні чисто протитічної регенерації привела до створення|створіння| схеми ступінчасто-протитічної| регенерації фільтрів, яка є|з'являється| проміжним варіантом між прямотічною| і протитічною регенераціями. Згідно|згідно з| цієї схемі розчин реагенту пропускається послідовно через два окремі відсіки, завантажених різною кількістю іоніту, як це робиться|чинить| при прямотічній| регенерації. При цьому, природно, іоніт у верхньому відсіку регенерується краще, ніж в нижньому|. Пропуск же води здійснюється спочатку через нижній відсік, а потім через верхній. Ця система регенерації дозволяє отримати|одержувати| якісніше очищення при скороченні на 30 – 40% кількостей реагенту на регенерацію. Більш ефективна| регенерація при застосуванні двухпоточно-протитічних| фільтрів з|із| середньою дренажною системою. При цьому частина|частина| регенераційного розчину подається знизу протитечією, а одночасно інша частина|частина| розчину подається зверху прямотоком|. Відведення регенераційного розчину проводиться|виробляє| через середню дренажну систему (рис. 3.9). Розпушування всього шару в такому
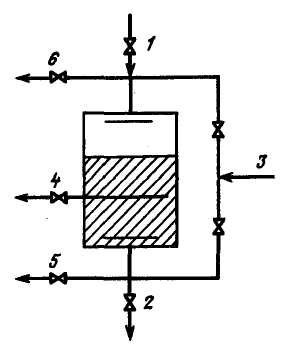
Рис. 3.9. Принципова схема двухпоточно-протитічного фільтру:
1—підведення оброблюваної води; 2 – відведення фільтрату; 3 – підведення регенераційного розчину; 4 – відведення регенераційного розчину; 5 – підведення води для розпушування; 6 – відведення води для розпушування
фільтрі проводиться|виробляє| потоком води знизу вгору з|із| відведенням води через верхню дренажну систему. Така регенерація дозволяє отримати|одержувати| воду дуже високої якості. Теоретичні уявлення про динаміку іонного обміну в сукупності з|із| обробкою експериментальних даних дозволили вивести розрахункове рівняння вихідний кривої іонування на катіоніті КУ-2
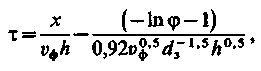
| (3.38) |
де τ – час фільтрування, год.;
υф – швидкість фільтрування, м/год.;
dз – діаметр зерен катіоніту, мм;
х – висота шару катіоніту, м;
φ = Сх/Со; h = Cо/qо;
Со і Сх – концентрації іона відповідно початкова і у фільтраті;
qо – концентрація даного іона, сорбованого катіонітом.
Аніонування водипроводиться з метою видалення з неї аніонів; при поєднанні аніонування з катіонуванням відбувається видалення з води як аніонів, так і катіонів, тобто хімічне знесолення води. При фільтруванні через шар аніоніту відбувається сорбція аніонів згідно наступним реакціям:
| R/ОН + Cl– ⇄R/Cl– + OH–; | (3.39) |
| 2R/OH + SO42– ⇄R2/SO42– + OH–. | (3.40) |
Перехід у воду іонів ОН– приводить до підвищення її рН, що у свою чергу супроводжується дисоціацією слабких кислот Н2СО3 і H2SiО3 і перекладу їх в іонний стан. Отже, вони також можуть брати участь в реакціях обміну, але лише при використанні високоосновних аніонітів:
| R/ОН– + Н+ + НСО3– ⇄R/НСО3– + Н2О; | (3.41) |
| R/ОН– + Н+ + НSiО3– ⇄R/НSiО3– + Н2О. | (3.42) |
Слід зауважити, що при аніонуванні кислої води можливість|спроможність| підвищення концентрації іонів ОН– у воді виключається, оскільки|тому що| ці іони при переході у воду зв’язуються іонами водню.
Якщо високоосновний| аніоніт знаходиться|перебуває| у Сl-формі, то з|із| води сорбуються іони NO3–|, SO42– і бікарбонат-іони
| R/Cl– + НСО3– ⇄R/НСО3– + Cl–; | (3.43) |
| 2R/Cl– + SО42– ⇄R/SО42– + 2Cl–; | (3.44) |
| R/Cl– + NО3– ⇄R/NО3– + Cl–. | (3.45) |
Згідно|згідно з| ряду селективності для аніонів в аніонітному фільтрі при використанні низькоосновних| аніонітів попереду йде|з'являється| зона іонів хлору і вони першими проскакують| у фільтрат. Це дає можливість|спроможність| визначати час виходу аніонітного| фільтру на регенерацію за концентрацією хлоридів. При використанні високоосновних аніонітів| попереду| йде|з'являється| зона найменш сорбуємої| кремнієвої кислоти, над нею розташовується змішана зона поглинання кремнієвої кислоти і бікарбонат-іона|, а ще вище – змішана зона цих аніонів і аніонів сильних кислот. Після досягнення фронту сорбції кремнієвої кислоти нижньої межі аніоніту| починається|починає| її проскакування, і це відповідає моменту відключення фільтру на регенерацію.
Регенерація аніонітних| фільтрів проводиться|виробляє| зазвичай|звично| 4%-им| розчином NaOH|, при цьому відбуваються|походять| наступні|слідуючі| реакції:
| R/Cl– + nOH– ⇄R/OH– + Cl– + (n – 1)OH–; | (3.46) |
| R2/SO42– + nOH– ⇄2R/OH– + SО42– + (n – 2)OH–; | (3.47) |
| R/НСО3– + nOH– ⇄R/OH– + НСО3– + (n – 1)OH–; | (3.48) |
| R/HSiO3– + nOH– ⇄R/OH– + HSiO3– + (n – 1)OH–; | (3.49) |
| НСО3– + OH– ⇄СО32– + H2O; | (3.50) |
| HSiO3– + OH– ⇄SiO32– + H2O. | (3.51) |
Залишковий вміст|зміст| іонів кремнієвої кислоти залежить від умов регенерації фільтру. При прямотічній| регенерації для отримання|здобуття| води з|із| вмістом кремнію 0,1 – 0,15 мг/кг SiO32– – питома витрата лугу повинна більш ніж в 5 разів перевищувати стехіометричний| (5,6 г-екв/г-екв проти|супроти| 1 г-екв/г-екв). В наш час|нині| для аніонітів| застосовують протитічну і ступінчасто-протитічну| схеми регенерації|, що дозволяють істотно|суттєвий| (на 30 – 40%) зменшити витрату реагенту. За схемою ступінчасто-протитічної| регенерації (рис. 3.10) розчин реагенту пропускається послідовно через два відсіки, завантажених різною кількістю аніоніту|: у нижньому| 70 – 75%, у верхньому 25 – 30%. У цьому ж напрямі|направленні| пропускається відмивна вода. Після закінчення відмивання фільтр перемикається|переключає| на аніонування|, при якому вода проходить спочатку через нижній відсік, а потім через більш добре відрегенерований іоніт верхнього відсіку. При завантаженні|загрузці| обох відсіків високоосновним аніонітом залишковий вміст кремнію|, рівний 0,1 мг/кг SiO32–, може бути забезпечений при питомій витраті NаOH| в межах 2 – 2,5 г-екв/г-екв.
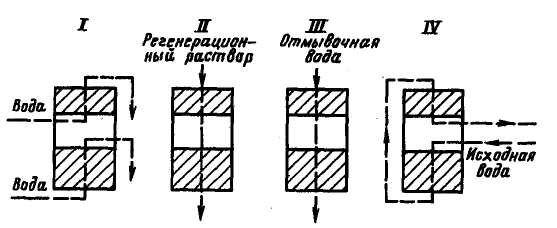
Рис. 3.10. Технологічна схема ступінчасто-протитічної| регенерації:
І – розпушування; ІІ – пропускання регенераційного розчину; ІІІ – відмивання; IV – робочий цикл
Основним завданням при використанні ОН-аніонітних фільтрів з високоосновним аніонітом в схемах знесолення є видалення кремнієвої кислоти з води, тому надзвичайно важливо для підвищення ємкості аніоніту по кремнієвій кислоті зменшувати вміст більш селективного бікарбонат-іону у воді, що поступає на іонування. У схемах ВПУ це здійснюється шляхом десорбції СО2 з кислої Н-катіонованої води в деаераторах або декарбонізаторах.
Розрахункове рівняння вихідної кривої аніонітного фільтру (аніоніт АВ-17) по кремнієвій кислоті має вигляд
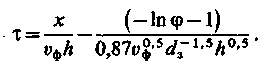
| (3.52) |
При використанні цього рівняння значення Со [див. (3.38)] визначається як сумарна концентрація всіх аніонів у воді, що поступають на фільтр.
Дата добавления: 2015-05-19; просмотров: 1984;
