Связь осмотического давления раствора с упругостью его пара.
Зная упругость пара над чистым растворителем (Р0) и над раствором (Р),можно вычислить осмотическое давление раствора.
Представим себе осмотическую ячейку 1, наполненную раствором и погруженную в сосуд с чистым растворителем 2 (рис.2).
Оба сосуда накрыты стеклянным колпаком, из-под которого выкачан воздух. Прибор остается некоторое время в покое при постоянной температуре Т.Растворитель поступает через полупроницаемую мембрану в осмотическую ячейку, пока давление столба жидкости не уравновесит величину осмотического давления. При установлении равновесия между упругостью пара чистого растворителя Р0 и упругостью пара раствора Рбудет существовать следующее соотношение:
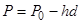 ****
****
где h — высота поднятия жидкости в осмометре, d — плотность паров растворителя, т. е. вес 1 см3 пара при давлении Р0. Иными словами, упругость пара на высоте h меньше упругости пара на уровне поверхности чистого растворителя на величину, равную весу столба пара растворителя высотой h.
Поскольку пары подчиняются законам газового состояния, можно сравнительно лег ко вычислить, чему равняется d: 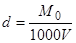 *****
*****
(рис.2).
где М0 — молекулярный вес растворителя, V — объем (в литрах), занимаемый одним грамм пара при давлении Р0.
Из уравнения Менделеева – Клапейрона имеем: Р0V=RТ или 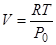
Подставим значение V из последнего уравнения в уравнение (*****), тогда:
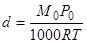
Подставим полученную величину dв уравнение (****), получим:
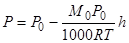 #
#
Осмотическое давление Пв осмометре равно весу столба раствора высотой h и сечением в 1 см2, т. е.
П=hS
где S — плотность раствора, которую для разбавленных растворов можно принять равной плотности чистого растворителя. Из последнего уравнения находим hи, подставив его значение в уравнение (#), получим:
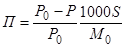 ##
##
Эта формула устанавливает зависимость между осмотическим давлением раствора и упругостью его насыщенного пара. Зная упругость пара раствора, легко вычислить осмотическое давление его.
Из первого закона Рауля для сильно разбавленных растворов имеем:
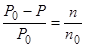
Подставив это выражение в уравнение (##), получим:
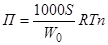
где: W0=M0n0; в последнем уравнении (т.к. PV=nRT):
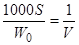
где V— объем растворителя (л).
В итоге, объединив последние два равенства, получим уравнение Вант-Гоффа:
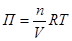 или
или 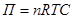
Дата добавления: 2015-05-13; просмотров: 1232;
