Отступление от законов Вант-Гоффа и Рауля в растворах электролитов.
Законы Вант-Гоффа и Рауля справедливы для идеальных растворов, в которых не происходит химическое взаимодействие между компонентами раствора, а также диссоциация или ассоциация молекул растворенного вещества. Однако опыт показывает, что не все растворы подчиняются этим законам. Установлено, что растворы, которые способны проводить электрический ток (электролиты), имеют более высокое, чем по закону Вант-Гоффа, осмотическое давление. Эти растворы кипят при более высокой температуре и замерзают при более низкой, чем это следует из закона Рауля. Такими свойствами обладают растворы солей, кислот и оснований.
Обобщая наблюдения, Вант-Гофф пришел к выводу, что в отношении осмотического давления растворы электролитов ведут себя так, как будто они содержат больше частиц, чем это следует из аналитической концентрации. Исходя из этого, Вант-Гофф внес в соответствующие уравнения для растворов электролитов поправку, получившую название коэффициента Вант-Гоффа или изотонического коэффициента (i). При этом Р = iСRТ.
Изотонический коэффициент показывает, во сколько раз наблюдаемое осмотическое давление (Рпр) раствора больше теоретически вычисленного (Ртеор) для раствора неэлектролита.
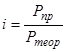
Отсюда следует:
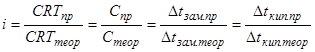 *
*
Таким образом, коэффициент iможно найти, если измерить непосредственно осмотическое давление с помощью осмометра Пфеффера или криоскопическим методом, что значительно проще.
Коэффициент Вант-Гоффа для неэлектролитов, растворенных в воде, равен 1, а для электролитов он больше единицы. Значение коэффициента растет по мере разбавления электролита. Для растворов, в которых имеет место ассоциация молекул растворенного вещества, коэффициент iбывает меньше единицы.
Причину отклонения от законов Вант-Гоффа и Рауля в растворах электролитов впервые разъяснил шведский ученый С. Аррениус в своей теории электролитической диссоциации. Она основывалась на трех постулатах.
1. Электролиты обладают способностью при растворении в соответствующих растворителях (например, в воде, к которой первоначально и относилась теория Аррениуса) диссоциировать на противоположно заряженные частицы – ионы. При этом молекулы кислот распадаются на положительные ионы водорода и отрицательные ионы кислотного остатка: H2SO4=2H++SO42-.
Молекулы оснований — на положительные ионы металла в отрицательные гидр оксид- ионы: кон=к++ н-.
Соли (средние) образуют положительные ионы металла и отрицательные ионы кислотного остатка: KCl=K++Cl-.
Кислые и основные соли, помимо ионов металлов и кислотного остатка, дают также в растворе ионы водорода или гидроксид-ионы: КН2РO4 = К++2Н++РО3-; А1(ОН)SО4=А13++ SО42-+ОН -.
Таким образом, электролиты при растворении в воде распадаются на ионы, за счет чего увеличивается число частиц. Это увеличение числа частиц и влияет на осмотическое давление и температуры кипения и замерзания растворов, т. е. свойства электролитов определяются суммой концентраций частиц — ионов и недиссоциированных молекул.
2. Электролиты при растворении диссоциируют на ионы не полностью. Доля молекул, распавшихся в состоянии равновесия на ионы, количественно характеризуется степенью электролитической диссоциации и обозначается через a.
Степень электролитической диссоциации равна отношению числа молекул п, распавшихся на ионы, к общему числу растворенных молекул N.
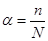
Величина степени электролитической диссоциации зависит от природы растворенного вещества и растворителя, а также от концентрации и температуры раствора.
Если вещество не диссоциирует при растворении (п = 0, a= 0), оно не будет электролитом. Если а близка к единице, то п= N,и соединение является сильным электролитом. Для многих химических соединений 0 < a < 1, следовательно, п < N,т. е. они будут слабыми электролитами.
По способности к диссоциации Аррениус разделил все электролиты на три группы: сильные электролиты (a> 30%), электролиты средней силы (a= 5 — 30%), слабые электролиты (a< 5%). К сильным электролитам были отнесены: соляная, бромисто-водородная, йодисто-водородная, азотная, серная, марганцовая кислоты; щелочи, гидроокись бария, а также большинство солей. Согласно теории Аррениуса для сильных электролитов характерна значительная диссоциация и, следовательно, хорошая электропроводность.
К слабым электролитам относятся почти все органические кислоты (муравьиная, уксусная, бензойная), цианистоводородная кислота, борная кислота, угольная кислота, сероводородная кислота, гидроокись аммония, вода, а также некоторые соли (Н§С12, СсЮ12). Для растворов слабых электролитов характерна очень небольшая величина электро-проводности.
К электролитам средней силы относятся фосфорная, мышьяковая, йодная, хромовая, сернистая кислоты и целый ряд других соединений,
3. Силы взаимодействия между ионами отсутствуют и растворы электролитов ведут себя подобно идеальным газовым системам. Это положение автором теории электролитической диссоциации и его последователями прямо не высказывалось, но оно лежит в основе всех ее количественных соотношений.
При помощи трех постулатов теория электролитической диссоциации смогла объяснить многие свойства раствора, дать их количественную характеристику и истолковать многочисленные факты и закономерности.
В своих работах Аррениус показал, что степень диссоциации электролита а можно связать с коэффициентом Вант-Гоффа i. Предположим, что в растворе находилось Nмолекул электролита, из которых только ппродиссоциировало на ионы. Число непродиссоциированных молекул N - п,а число образовавшихся ионов n п , где n — количество ионов, на которое диссоциирует одна молекула электролита. Тогда число всех частиц в растворе, включая и молекулы, и ионы, будет равно (N—п)+n п, или после соответствующего преобразования: N+n(n-1), подставим в уравнение(*):
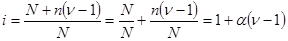
откуда
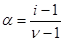
Из всего вышеизложенного можно сделать следующие выводы.
1. Растворы электролитов будут изотоничными, если при одинаковой температуре они содержат одинаковое число частиц (молекулы + ионы) в единице объема.
2. Из двух растворов с одинаковой молярной концентрацией осмотическое давление будет выше в растворе электролита с более высокой степенью диссоциации a.
3. Из двух растворов с одинаковой молярной концентрацией и степенью диссоциации a осмотическое давление будет выше в растворе электролита, диссоциирующего на большее число ионов.
Дата добавления: 2015-05-13; просмотров: 1748;
