Основные положения теории сильных электролитов
Как уже упоминалось, величина электропроводности сильных электролитов далеко не соответствует полной диссоциации их молекул на ионы. Однако при оптических и спектральных исследованиях растворов сильных электролитов в них не обнаруживается характерных свойств молекул, что отличает эти растворы от растворов слабых электролитов, в которых можно обнаружить недиссоциированные молекулы. Рентгенографическое исследование кристаллов сильных электролитов, например КС1 и НаС1, показало, что эти электролиты даже в твердом агрегатном состоянии не содержат молекул и имеют ионные кристаллические решетки. Однако если принять полную диссоциацию сильных электролитов и этим ограничиться, то совершенно необъяснимы будут другие явления. Например, экспериментально определяемые величины понижения температуры замерзания и повышения температуры кипения оказываются у сильных электролитов меньше, чем следовало бы ожидать при полной диссоциации молекул на ионы. Таким образом, теория электролитической диссоциации уже не могла полностью объяснить всех свойств растворов.
В 1923 г. Дебай и Гюккель создали теорию сильных электролитов.
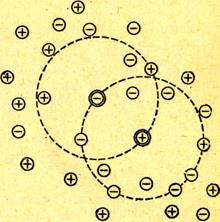
Со гласно этой теории в растворах сильных электролитов действуют электростатические силы притяжения между разноименными ионами и силы отталкивания — между одноименными. Вокруг каждого иона образуется ионная атмосфера, состоящая из ионов противоположного знака. Каждый из ионов этой атмосферы находится в окружении другой ионной атмосферы. Поэтому раствор сильного электролита можно рассматривать как систему равномерно распределенных по всему объему сосуда разноименных ионов, каждый из которых
находится в центре силового поля, создаваемого окружающими ионами (рис. 1).
|
Тепловое движение постоянно изменяет картину распределения ионов в такой сфере: в ней происходит постоянный ионный обмен. Ввиду того, что радиус ионной атмосферы относительно велик, атмосферы двух соседних ионов
пересекаются, в результате чего каждый ион в данный момент может входить в состав одной или даже нескольких ионных атмосфер других ионов.
Все это обусловливает довольно сложные взаимоотношения между компонентами раствора, которые не могут не сказаться на его свойствах.
Рис. 1. Модель ионной атмосферы,
Дата добавления: 2015-05-13; просмотров: 2431;
