Осмос и осмотическое давление
Диффузия может проходить также, если на границе раствора и чистого растворителя (или двух растворов различной концентрации) поместить полупроницаемую перегородку — мембрану. Полупроницаемые перегородки способны пропускать только молекулы растворителя и не пропускают молекулы растворенного вещества. Свойством полупроницаемости обладают многие природные пленки (стенки клеток живых и растительных организмов, стенки кишечника, протоплазма и др.), а также пленки искусственного происхождения (целлофан, пергамент, пленки из коллодия, желатины). Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану в раствор или из раствора с низкой концентрацией в раствор с высокой концентрацией называется осмосом.
Процесс осмоса очень сложен и природа его в настоящее время еще недостаточно выяснена.
Механизм осмоса может быть различен и зависит в основном от природы мембраны. В одних случаях мембрана взаимодействует с растворителем, образуя с ним непрочные соединения промежуточного характера. В других случаях через мембрану могут свободно проходить только те вещества, которые обладают способностью растворяться в ней. Мембрана может представлять собой просто пористую перегородку с порами определенного размера. Осмос можно наблюдать в специальных приборах, которые называются осмометрами. Простейшая схема осмометра приведена на рис. 1.
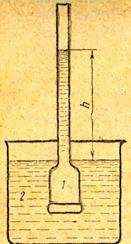
|
Основной его деталью является осмометрическая ячейка 1, отделенная от сосуда 2 с чистым растворителем полупроницаемой мембраной, пропускающей только молекулы растворителя, но не растворенного вещества. Ячейку с концентрированным раствором погружают в сосуд с растворителем — менее концентрированным раствором. Спустя некоторое время отмечается значительное повышение уровня жидкости в трубке. Объясняется это тем, что с поверхностью мембраны снизу сталкивается больше молекул растворителя, чем сверху, так как сверху часть поверхности занята также молекулами растворенного вещества, не проникающего сквозь мембрану. Поэтому в единицу времени вверх переходит значительно больше молекул растворителя, чем в обратном направлении.
Рис.1.
В этом случае мы сталкиваемся с проявлением одного из общих свойств естественных самопроизвольных процессов: в природе самопроизвольно протекают процессы, направленные в сторону выравнивания в системе температур, давлений, электрических потенциалов, концентраций и т. д. Эти процессы находятся в полном соответствии со вторым началом термодинамики. Концентрация растворителя в сосуде 2 больше, чем в ячейке, и поэтому поток растворителя направлен в сторону ячейки. Уровень жидкости в осмометрической трубке будет повышаться, пока гидростатическое давление столба жидкости высотой hне задержит осмос. В этом случае уравновешиваются скорости прохождения растворителя из наружного сосуда в ячейку и из ячейки в наружный раствор, подъем жидкости в осмометре прекращается. Гидростатическое давление, которое надо приложить к раствору, чтобы задержать осмос, называют осмотическим давлением. Осмотическое давление растворов обычно измеряют или рассчитывают по отношению к чистому растворителю. Измеряется осмотическое давление в атмосферах или в миллиметрах ртутного столба (н/м2).
Как показали исследования, осмотическое давление зависит в первую очередь от концентрации раствора и может достигать больших значений. Так, 6%-ный раствор сахара имеет осмотическое давление 60 800 н/м2, морская вода 2 840 000 н/м2, рассолы самосадочных озер—более 20 300 000 н/м2.
Дата добавления: 2015-05-13; просмотров: 1560;
