Растворимость твердых веществ в жидкостях.
Растворимость твердых веществ также определяется природой растворителя и растворенного вещества и также зависит от температуры. В отличие от растворимости газов, растворимость твердых тел сравнительно мало изменяется с давлением.
Различия в растворимости твердых тел можно иллюстрировать примерами. В 100 г воды при 25° С растворяется 257 г AgNO3 и лишь 3•10-20 HgI. Вода — хороший растворитель сахара, а спирт его практически не растворяет. Нафталин очень хорошо растворяется в спирте и не растворим в воде.
Следует заметить, чnо вследствие отсутствия общей теории растворов вопрос о зависимости растворимости от физико-химических свойств растворителя и растворенного вещества еще нельзя считать до конца решенным, и конкретные сведения о растворимости твердых тел целиком основаны на опытных данных.
В настоящее время установлен ряд правил о растворимости веществ, но они не обладают универсальностью, не свободны от различного рода исключений и потому носят в большинстве случаев качественный характер. Например, было замечено, что неполярные растворители, как правило, хорошо растворяют полярные вещества и плохо неполярные. Неполярные растворители, наоборот, хорошо растворяют, неполярные, вещества и плохо — полярные. В том случае, если один из компонентов раствора полярен, а второй неполярен, растворимость бывает незначительной.
Растворимость большинства твердых веществ с повышением температуры увеличивается. однако бывают и исключения. Так, растворимость СаCrО4 и Са(ОН)2 в воде с повышением температуры уменьшается.
|
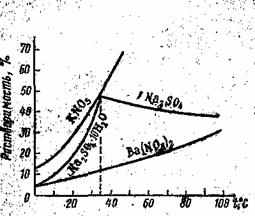
Зависимость растворимости от температуры обычно изображают в виде кривых растворимости. На рис. 3 приведены кривые растворимости некоторых солей в воде.
Рис. 3. Зависимость растворимости солей в воде от температуры.
Резкий излом на кривой растворимости сульфата натрия соответствует превращению Na2SO4•10Н2O в безводный Na2SO4. Растворение кристаллогидрата Na2SO4•10Н2O сопровождается поглощением тепла, а растворение безводной соли идет с выделением тепла.
Если соль способна к образованию кристаллогидратов (рис. 4), то химический состав и область существования каждого кристаллогидрата можно сравнительно легко определить по характерным кривым растворимости: каждой точке перехода соответствует излом на кривой растворимости.
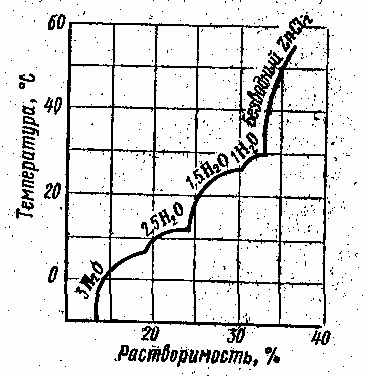
Рис. 4. Зависимость растворимости ZnCl2 в воде от температуры.
Изменением растворимости с температурой часто используются для очистки веществ путем перекристаллизации.При остывании горячего насыщенного раствора какой либо соли, загрязненной примесями, значительная часть соли выделится осадок, а загрязняющие примеси остаются в растворе, так как последний даже на холоде не будет насыщенным раствором по отношению к примесям.
Дата добавления: 2015-05-13; просмотров: 1875;
