Новые факторы риска
Лабораторные методы исследования
Широкое внедрение в акушерскую практику современных диагностических технологий, таких как определение уровней Р‑ХГЧ, АФП, РАРР‑А, ультразвуковая допплерометрия, ELI‑P‑TEST, КТГ, определение антифосфолипидных антител, волчаночного антикоагулянта, D‑димера, исследование гемостазиограммы, выявление гиперандрогении, позволило выявлять нарушения в организме беременной и в состоянии плода, представляющие перспективную угрозу неблагополучного перинатального исхода. В этом случае полученные результаты лабораторных и инструментальных методов исследования можно трактовать как факторы риска.
Плацентарные белки (более 60) исполняют роль гормонов, ферментов, проферментов, рецепторов, факторов роста, иммунорегуляторных агентов, транспортных и связывающих белков. Интерес к этим белкам обусловлен попытками использовать определение их содержания в крови матери для прогноза осложнений беременности.
АФП – это одноцепочечный гликопротеид с молекулярной массой от 66 000 до 72 000 Д и 3–5 % содержанием углеводов. D. Gitlin установил, что АФП синтезируется эмбриональной печенью и желточным мешком, и назвал его альфа‑фетопротеином. В дальнейшем было показано, что на ранних этапах беременности АФП может синтезироваться и в тканях желудочно‑кишечного тракта эмбриона, почках, сосудах. Начиная с 12‑й недели беременности, основным местом синтеза АФП становится печень эмбриона.
АФП тесно связан со многими процессами, происходящими в организме беременной женщины, в частности с состоянием гемостаза в фетоплацентарном комплексе. Определение концентрации АФП в сыворотке крови матери во II триместре беременности, наряду с хорионическим гонадотропином, вошло в диагностическую практику, что позволяет успешно выявлять врожденные и наследственные заболевания.
Выявлена способность АФП к специфичному связыванию с эстрогенами, что способствует релаксации матки и сохранению беременности. Установлено, что АФП служит физиологическим иммунодепрессантом в период развития зародыша, подавляющим экспрессию продуктов главного комплекса гистосовместимости на мембране макрофагов. Многие исследования посвящены способности АФП регулировать рост эмбриональных тканей. O. Liang и соавт. показали, что АФП принимает активное участие в ангиогенезе плаценты, усиливая стимулирующее влияние фактора сосудистого эндотелиального роста. Иммунологическими методами было показано, что АФП, выявляемый в ворсинах хориона во второй половине беременности, имеет фетальное происхождение, в то время как ранний цитотрофобласт обладает способностью его синтезировать.
АФП взаимодействует с инсулином, стимулируя синтез и накопление углеводов, липидов и протеинов. Доказано, что в физиологических дозах инсулин стимулирует рост эмбриона, а высокие дозы его оказывают тератогенный эффект, вызывая в ранние сроки эмбриогенеза пороки развития нервной трубки, в поздние – ахондроплазию, задержку развития и гибель плода. Было установлено, что АФП – универсальный неспецифический маркер задержки роста плода.
По мнению С. Н. Пернакова и соавт., при наличии кист, гиперплазии ворсин, расширения межворсинчатого пространства уровень АФП в крови матери повышается, что характерно для плацентарной недостаточности. По данным Г. М. Савельевой и соавт., наоборот, на фоне аномалий плаценты уровень АФП в крови матери снижается. Снижение уровня АФП наблюдается и при предлежании плаценты, миоме матки, когда создаются анатомические препятствия для полноценного плацентарного кровотока.
Некоторые исследователи считают, что при повышении уровня АФП в первой половине беременности увеличивается риск развития хориоамнионита, угрозы прерывания беременности во второй ее половине, гестоза, слабости родовой деятельности и преждевременных родов. Результаты, полученные другими исследователями, напротив, свидетельствуют о том, что именно низкая концентрация АФП в крови в 16–20 недель сопряжена с такими осложнениями гестационного процесса, как гестоз, инфекция фетоплацентарной системы, анемия, хроническая гипоксия плода, угроза прерывания беременности.
Отклонение уровня АФП в крови матери от нормативов может быть связано с патологией околоплодной среды. Так, по данным Г. М. Савельевой и соавт., при увеличении или уменьшении количества околоплодных вод уровень АФП в крови матери повышается, при этом при маловодии это повышение свидетельствует о более серьезной патологии плода. M. Pernec и соавт. считают, что при маловодии концентрация АФП в сыворотке крови матери резко повышена. В то же время при маловодии выявлены низкие уровни АФП в сыворотке крови беременной на фоне достоверного увеличения содержания АФП в околоплодных водах, а при многоводии высокая концентрация АФП в околоплодных водах и пуповинной крови соответствует нормальным показателям, характерным для данного срока беременности.
Таким образом, у женщин с повышенным и пониженным уровнем АФП увеличивается риск развития осложнений беременности и заболеваний у новорожденных.
Первый из белковых гормонов, продуцируемый при беременности – хорионический гонадотропин (ХГЧ) был открыт Ашгеймом и Цондеком в 1927 г. По своему строению ХГЧ относится к гликопротеидам и синтезируется синцитиотрофобластом, а по структуре и биологическому действию сходен с лютеинизирующим гормоном (ЛГ). ХГЧ состоит из двух субъединиц (альфа и бета – ХГ) – мономеров, образующихся при его диссоциации. Биосинтез каждой из них зависит от индивидуального гена и осуществляется на полирибосомах синцитиотрофобласта. Эти субъединицы различаются по углеводному и аминокислотному составу и биологическому значению. Наиболее точно функцию плаценты отражает Р‑ХГЧ. В ранние сроки беременности Р‑ХГЧ стимулирует стероидогенез в желтом теле яичника. Снижение экскреции Р‑ХГЧ совпадает по времени с прекращением функции желтого тела и с завершением процесса формирования стероидной функции плаценты. Во второй половине беременности ХГЧ стимулирует синтез эстрогенов в плаценте, участвует в ароматизации андрогенов. Существует мнение, что ХГЧ усиливает стероидогенез в коре надпочечников плода и тормозит сократительную активность миометрия. Р‑ХГЧ – наиболее активный модулятор иммунных реакций.
Из синцитиотрофобласта Р‑ХГЧ транспортируется в кровь плода и матери. В крови плода его уровень в 10–20 раз ниже, чем в крови беременной, где ХГЧ обнаруживают сразу после имплантации плодного яйца.
Результаты измерения содержания Р‑ХГЧ могут быть использованы для лабораторного наблюдения за беременными групп высокого риска.
Несвоевременное появление пика Р‑ХГЧ указывает на нарушение формирования трофобласта, возникновение первичной ПН. Снижение уровня этого гормона на 40 % и более по сравнению с физиологическим значением может свидетельствовать о недостаточной продукции гормона в ткани хориона, наличии субкомпенсированной ПН. Дальнейшее снижение уровня Р‑ХГЧ указывает на развитие процессов декомпенсации в ФПК.
PAPP‑A (pregnancy‑associated plasma protein‑А) – гликопротеид с большой молекулярной массой (740кДа); он выявляется в плазме крови матери, начиная с 5‑й недели до конца беременности. Кроме того, этот белок обнаружен в меньших концентрациях в плазме крови небеременных женщин, фолликулярной жидкости, цервикальной слизи и семенной жидкости. Специальными иммуноморфологическими методами PAPP‑A выявлен в гранулах апикальной зоны синцитиотрофобласта ворсин плаценты. Другая локализация синтеза PAPP‑A была определена иммуногистохимически в интерстициальных клетках Лейдига яичек и придатков у плодов и взрослых мужчин. Выявление уровня PAPP‑A используется для скрининга ряда врожденных и наследственных заболеваний, однако его роль в развитии плода и течении беременности остается недостаточно изученной.
Для оценки степени риска аномального развития плода был разработан метод ELI‑P (ELISA – detected Probability of Pathology in Pregnancy), с помощью которого определяют сывороточное содержание естественных регуляторных аутоантител, взаимодействующих с белками ОБМ, S100, ACBP14/18 и MP65. Поддержание их физиологических концентраций – одно из условий нормального эмбриогенеза. Убедительно доказано, что репродуктивная функция женщины, ее способность к вынашиванию беременности и рождению здорового ребенка во многом зависят от состояния системы естественных эмбриотропных аутоантител.
Сочетание инфекционного агента и аутоиммунной патологии оказывает существенное влияние на сам плод, экстраэмбриональные структуры, сосудистое русло матери. Проведенные исследования позволили выявить взаимосвязь между этими системами и клиническим состоянием функциональной системы мать‑плацента‑плод, а также морфологическими изменениями фетоплацентарной системы.
Немногочисленные публикации, посвященные прогнозированию аномалий развития плода с помощью биотехнологического метода ELI‑P‑TEST, содержат информацию о том, что система естественных регуляторных аутоантител весьма лабильна и быстро реагирует на самые разные влияния среды. Исследования Н. Т. Хахва показали эффективность ELI‑P‑TEST в прогнозировании развития гестоза, частота которого возрастает в группах с гиперреактивными показателями. Если у здоровых женщин (нормореактивность) гестоз не развивается, то у беременных с повышенными с ранних сроков беременности цифрами сывороточной иммунореактивности гестоз развивается в 100 % наблюдений.
ELI‑P‑TEST может использоваться и для прогнозирования возможного развития аномалий сократительной деятельности матки. Н. Г. Снигиревой и соавт. у 90 % женщин с различными аномалиями сократительной деятельности матки установлено наличие изменений в иммунной системе. В таких случаях анализ состояния естественных эмбриотропных аутоантител служит важным прогностическим тестом. По данным В. И. Кулакова, нарушение функции регуляторных аутоантител, особенно при наличии АФС, осложняет течение беременности, послеродового периода и увеличивает риск антенатальных и перинатальных потерь.
Термин «антифосфолипидный синдром» был введен в 1987 г. Патогенетической основой АФС становится развитие хронического ДВС‑синдрома.
Еще в начале 1960‑х гг. в процессе клинических наблюдений за больными, в сыворотке которых обнаруживали волчаночный антиген (ВА), обратили внимание на парадоксальный факт – присутствие ВА ассоциируется не с кровоточивостью, как это можно было ожидать с учетом способности антител in vitro удлинять время свертывания крови, а с развитием тромботических осложнений.
Истинная распространенность АФС в популяции до сих пор неизвестна. В общей популяции АФС чаще выявляется у женщин, чем у мужчин, однако нередко встречается у детей и новорожденных.
Данные последних лет подтверждают роль АФС в патогенезе разнообразных заболеваний человека, среди которых ведущее место принадлежит тромбозам.
По обобщенным данным мировой литературы, на каждые 1000 родов приходится 2–5 случаев тромботических осложнений. До 50 % венозных тромбозов возникают у женщин до 40 лет, и, как правило, все они связаны с беременностью.
Диагноз АФС правомочен при наличии по крайней мере одного (любого) клинического и одного (любого) лабораторного признака, причем желательно повторное выявление антител через 2–3 месяца для исключения случайного титра. Положительный тест на волчаночный антикоагулянт даже однократно, особенно на фоне беременности, – достоверный признак АФС.
К настоящему времени круг патологических состояний, обусловленных циркуляцией антифосфолипидов, значительно расширен. К ним относятся осложнения при приеме оральных контрацептивов, рецидивирующие тромбозы при беременности и в анамнезе, досрочное завершение беременности, ПН и ЗРП, ПОНРП, HELLP‑синдром, гестационная гипертензия, тромбоцитопения, инсулинзависимый сахарный диабет, гестозы с ранним началом и тяжелым течением.
Развитие осложнений беременности у пациенток с антителами к фосфолипидам может быть обусловлено децидуальной и плацентарной васкулопатией, в результате чего возникают инфаркты. Наряду с мнением о том, что при отсутствии клинических проявлений лечение не является необходимым, имеются и сторонники антикоагулянтной и антиагрегантной терапии. А. Д. Макацария рекомендует следующие критерии для назначения антикоагулянтной терапии:
• наличие волчаночного антикоагулянта;
• высокий титр антифосфолипидных антител > 1:40;
• сопутствующие заболевания и другие формы проявления АФС (привычное невынашивание, гестоз, ЗРП, неудачные попытки ЭКО и искусственного осеменения;
• наличие генетических форм тромбофилии.
По данным Н. В. Кузьминой, в шкалу необходимо добавить факторы риска, свидетельствующие о патологии гемостаза: наличие волчаночного антикоагулянта – 4 балла риска, повышение фибриногена от 4,00 до 4,40 – 1 балл риска, повышение фибриногена от 4,41 и выше – 2 балла риска, уровень D‑димеров от 0,49 мкг/мл и выше – 4 балла риска, антифосфолипидные антитела: IgG от 9,99 и выше – 2 балла риска, IgM от 9,99 и выше – 3 балла риска.
Среди факторов, приводящих к перинатальной патологии и антенатальной гибели плода, возросла роль эндокринной патологии, в том числе гиперандрогении различного генеза. Одна из особенностей клинического проявления гиперандрогении – наличие так называемых «стертых форм». Такая неклассическая ее форма присутствует почти у 1 % общей популяции. Клинические проявления в этом случае отсутствуют или крайне незначительны. Однако известно, что беременность и роды могут проявить скрытую дисфункцию органов и систем. В этих условиях имеющаяся ферментативная неполноценность способна проявиться и повлечь за собой ряд гестационных осложнений. Частота патологии беременности при гиперандрогении составляет от 21 до 48 %, по данным различных авторов.
Оценка состояния плода По данным В. Е. Радзинского и соавт., нарушение плацентарного кровотока на поздних сроках сопровождает большинство патологических процессов, происходящих во время беременности. Однако гемодинамические изменения, происходящие в плаценте и нарушающие нормальное развитие плода, берут свое начало в ранних периодах гестации, усугубляясь при различных экстрагенитальных заболеваниях и осложнениях беременности. В этой связи ценным дополнением к уже ставшим рутинным методам исследования стала ультразвуковая допплерометрия. Наиболее оптимальными для допплеровского исследования характера кровотока в МА, РА и СА можно считать 7–8 недель гестации, соответствующих «пику» первой волны инвазии цитотрофобласта, поскольку действие повреждающего агента именно на этих сроках может нарушить процесс формирования полноценного плацентарного ложа и плаценты, способствуя возникновению в дальнейшем плацентарной недостаточности.
Интересны сведения Б. С. Демидова о возможности антенатальной неинвазивной диагностики плацентарной недостаточности и ее фаз на основании допплерометрического исследования плацентарного кровотока, а также данные В. В. Шальнева и Г. М. Савельевой, продемонстрировавших возможность допплерометрической диагностики ранней плацентарной недостаточности.
Исследования Т. А. Духиной выявили основные закономерности становления маточно‑плацентарного кровотока функциональной системы мать‑плацента‑плод, динамику их изменений на ранних сроках гестации при нормальном и отягощенном течении беременности, что позволяет использовать ультразвуковую допплерометрию как дополнительный метод диагностики у пациенток, относящихся к группе повышенного риска возникновения различных осложнений беременности.
Вместе с тем в литературе имеются указания на низкую чувствительность и отсутствие прогностической ценности данного метода в отношении гипоксии плода и нецелесообразности использования ультразвуковой допплерометрии для скрининга патологии более поздних сроков беременности.
Важную информацию о состоянии плода позволяет получить кардиотокография (КТГ), являющаяся наиболее распространенным методом контроля за состоянием плода во время беременности и в родах.
По данным E. Salamalekis, широкое использование КТГ во время беременности и в родах позволило за 15‑летний период (с 1981 по 1995 г.) снизить перинатальную смертность с 15,2 до 3,7 ‰, т. е. в 4,1 раза. Была установлена четкая корреляция между антенатальной КТГ, патологическими изменениями рН крови плода и состоянием новорожденного.
В Германии в 86,4 % случаев проводится антенатальная кардиотокография плода, что способствует раннему выявлению и лечению патологических состояний плода. Доказано, что эффективность данного метода составляет от 60 до 95 % в зависимости от срока беременности.
Для повышения точности оценки состояния плода рядом авторов первоначально была предложена методика балльной оценки, а затем и математической расшифровки кардиотокограмм. Чаще других использовали классификации, предложенные Hammacher и Fisher и соавт.
По данным Н. В. Кузьминой, различная оценка данных КТГ по шкале W. M. Fisher имеет различную степень перинатального риска:
• > 7 баллов – 4 балла перинатального риска;
• < 7 > 6 баллов – 8 баллов перинатального риска;
• < 6 > 5 баллов – 12 баллов перинатального риска;
• < 5 > 4 баллов – 16 баллов перинатального риска;
• < 4 баллов – 20 баллов перинатального риска.
Разработанные компьютерные системы интенсивного наблюдения плода повысили эффективность КТГ.
Ценным и перспективным является нестрессовый тест, хотя было отмечено, что тесты могут давать неправильные результаты.
Результаты исследований С. Э. Сорокиной показали, что регистрация ритма со сниженной вариабельностью, а также децелераций, особенно поздних, становится фактором риска асфиксии плода в родах и гибели его в перинатальный период. Одной из причин появления патологических маркеров при КТГ во время родов может быть нарушение функции плаценты. В то же время в 21 % случаев гибели плода в перинатальный период изменения при КТГ не регистрируются, что свидетельствует о необходимости комплексной оценки состояния плода.
Проведенные исследования доказали, что комбинированное использование эхографии и кардиотокографии – ценный метод определения состояния плода.
Вспомогательные репродуктивные технологии В литературе имеются многочисленные и противоречивые сведения об особенностях течения и исхода беременности у женщин с бесплодием в анамнезе. Это объясняется не только многообразием причин бесплодия и способов его лечения, но и неоднородностью групп контроля. По данным отчета ВОЗ по методам вспомогательной репродукции только 14,9 % циклов ЭКО завершились рождением живых детей.
По данным О. Н. Аржановой, пациентки, у которых беременность наступила в результате ЭКО, составляют особую группу, отличающуюся не только от беременных с нормальной репродуктивной функцией, но и от беременных с длительным бесплодием в анамнезе. Пациентки программы ЭКО по совокупности факторов, связанных с этиологией и патогенезом бесплодия, характером и длительностью предшествовавшего лечения, возрастом, соматическим здоровьем, особенностями психоэмоционального статуса, проведенной индукцией суперовуляции и высокой частотой многоплодия должны быть отнесены к группе высокого риска по невынашиванию беременности, осложненного течения беременности и родов. Относительно ICSI (Intra Cytoplasmic Sperm Injection – инъекция сперматозоида в цитоплазму), то по данным A. M. Belker, метод лишь в 29 % случаев привел к рождению детей.
Вспомогательные репродуктивные технологии оцениваются: ЭКО в 1 балл перинатального риска, ICSI – в 2 балла риска.
Многоплодная беременность Многоплодная беременность составляет от 0,5 до 2,0 % всех родов и заканчивается рождением, как правило, двойни (twins), реже – тройни (triplets). Тройни составляют около 1 % от всех многоплодных родов. Согласно формуле Хеллина (Hellin\'s rule), в среднем, в популяции роды двойней встречаются с частотой 1:80 родов, тройней – 1:802 (64 00), четверней – 1:803 (512 0 00) и т. д. Однояйцевые двойни встречаются в среднем с частотой 0,2–0,4 % во всем мире. Среди многоплодных беременностей частота однояйцевых и многояйцевых двоен составляет 30 и 70 % соответственно. В отличие от многояйцевой двойни частота однояйцевой двойни довольно постоянна и не зависит от паритета, возраста матери и других факторов.
За последние десятилетия в экономически развитых странах отмечено увеличение числа случаев многоплодной беременности тремя и более плодами. Причины этого – широкое распространение с середины 1980‑х гг. вспомогательных репродуктивных технологий [assisted reproductive technology (ART)], таких как экстракорпоральное оплодотворение (ЭКО) [in vitro fertilization (IVF)] и подсадка эмбриона (ПЭ) (embryo transfer), использование в гинекологической практике стимуляторов овуляции. Частота многоплодной беременности после применения вспомогательных репродуктивных технологий возрастает в 10 раз (табл. 10).
Таблица 10 Варианты многоплодной беременности и их частота после ЭКО и ПЭ (%)
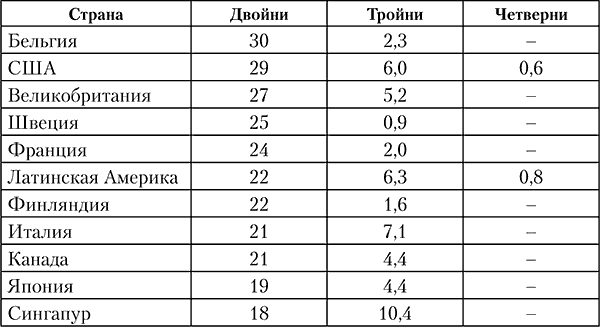
Частота монозиготных двоен одинакова в различных этнических группах и не зависит от возраста и паритета матери, но в 2–3 раза выше при использовании методов ЭКО. Объяснение этому факту находят в возможном повреждении архитектоники zona pellucida при проведении ЭКО. Патогенез возникновения монозиготной двойни до конца не ясен, однако не исключена роль повышенного уровня ФСГ в материнской крови. Отмечена и связь роста монозиготных двоен с использованием оральных контрацептивов.
Рост частоты дизиготных двоен в основном связывают с широким использованием вспомогательных репродуктивных технологий и увеличением материнского возраста.
Многоплодная беременность по шкале О. Г. Фроловой и Е. И. Николаевой оценивается в 3 балла риска. Однако женщины с многоплодной беременностью сравнительно редко имеют низкую степень риска. При многоплодной беременности к организму женщины предъявляются повышенные, зачастую чрезмерные требования: сердечно‑сосудистая система, легкие, печень, почки и другие органы функционируют с большим напряжением. В связи с этим многоплодная беременность протекает тяжелее одноплодной, и большая частота развития осложнений беременности увеличивает степень перинатального риска.
При многоплодии значительно чаще наблюдаются следующие осложнения беременности:
• анемия (1–4 балла);
• гестозы (2‑12 баллов);
• невынашивание (1–6 баллов);
• предлежание плаценты (3‑12 баллов);
• преждевременная отслойка плаценты (26 баллов);
• плацентарная недостаточность (2‑20 баллов);
• задержка внутриутробного развития плодов (1020 баллов);
• пороки развития плодов.
Вынашивание многоплодной беременности связано с высоким риском осложнений в отношении матери. Материнская заболеваемость и смертность при многоплодной беременности возрастает в 3–7 раз, и чем выше порядок многоплодия, тем выше риск материнских осложнений.
Так, риск развития гестоза у женщин при многоплодии достигает 45 %, анемия наблюдается в 50‑100 % случаев, развитие выраженного многоводия сопровождает течение до 60 % многоплодных беременностей. У женщин, имеющих сочетанные соматические заболевания, отмечается их обострение практически в 100 %.
При беременности двойней отмечается высокая частота развития гестоза. По мнению некоторых авторов, возможно, что у значительного числа беременных с двойней гипертензия и отеки развиваются вследствие избыточного увеличения внутрисосудистого объема, и их ошибочно относят к группе беременных с гестозом. В таких случаях скорость клубочковой фильтрации повышена, протеинурия незначительна или отсутствует, а определение величины гематокрита в динамике указывает на увеличенный объем плазмы. У этих беременных значительное улучшение наступает при соблюдении постельного режима. Следует помнить, что при многоплодной беременности может развиться истинный гестоз со спазмом сосудов, который в ряде наблюдений протекает чрезвычайно тяжело.
Анемию у беременных с двойней часто считают «обычным» осложнением, что связывают с увеличением внутрисосудистого объема. Поскольку основной его элемент – повышение объема плазмы, в конечном результате отмечается снижение величины гематокрита и уровня гемоглобина, особенно во II триместре беременности. На самом же деле происходит активный процесс кроветворения, и общий объем массы эритроцитов у пациенток с двойней выше, чем в начале беременности. Значительное увеличение эритропоэза во время беременности двойней может привести у некоторых пациенток к истощению ограниченных запасов железа и сыграть роль пускового механизма в развитии железодефицитной анемии. Исследование мазков крови – наилучший способ отличить физиологическую гидремию от железодефицитной при беременности двойней.
Одно из наиболее частых осложнений многоплодной беременности – преждевременные роды. Перерастяжение матки способствует выкидышам (35–50 %) и преждевременным родам (25 %). Чем больше число вынашиваемых плодов, тем чаще наблюдаются преждевременные роды.
Перинатальная заболеваемость и смертность при двойне зависит от зиготности и в большей степени – от хориальности. Так, по данным R. Derom и соавт. и G. Machin и соавт., перинатальная смертность при монохориальной двойне в 3–4 раза превышает таковую при бихориальной, независимо от зиготности. По крайней мере один случай внутриутробной гибели плода приходится на 12,7 % монохориальных и 2,5 % бихориальных двоен до 24 недель беременности и на 4,9 и 2,8 % – после 24 недель соответственно при моно– и бихориальной двойне. Процент преждевременных родов до 32 недель почти в 2 раза выше при монохориальной плацентации (9,2 против 5,5 %). При моноамниотической двойне, частота которой составляет 5 % среди монохориальных беременностей, гибель плодов достигает 50–70 %.
Определение зиготности, количества плацент и амниотических полостей имеет решающее значение для выработки тактики ведения беременности и родов при многоплодии, особенно когда имеется диссоциированное развитие плодов, водянка или гибель одного из плодов.
Дородовое определение зиготности возможно только на основании определения ДНК у плодов и требует проведения амниоцентеза, биопсии хориона или кордоцентеза, что связано с высоким риском осложнений при инвазивных вмешательствах. В то же время на основании зиготности нельзя судить о типе плацентации, поскольку при однояйцевой двойне возможна как моно‑, так и бихориальность, при которых ведение беременности и родов существенно различаются.
Большая роль в пренатальной диагностике хориальности принадлежит ультразвуковому исследованию, при котором устанавливается число плацент и наличие межплодовых перегородок. Если выявление двух плацент указывает на бихориальную плацентацию, то при наличии одной плаценты дифференциальная диагностика между моно– и бихориальной двойнями представляет значительные трудности. При многоплодной беременности в большинстве наблюдений 2 плаценты тесно примыкают друг к другу, что порой представляет трудности для дифференциальной диагностики сросшихся двух плацент и монохориальной плаценты. В связи с этим при эхографии часто происходит гипердиагностика монохориального типа плацентации.
Различная толщина межплодовых перегородок (при бихориальных плацентах перегородка между плодами состоит из 4 слоев: амнион‑хорион‑хорион‑амнион, в то время как при монохориальной только из 2: амнион‑амнион) позволила использовать этот показатель при УЗИ для определения хориальности двоен. Субъективная оценка большей толщины и большей эхогенности перегородок, толщина перегородки 2 мм и более стали ультразвуковыми критериями бихориальной двойни. Использование толщины перегородки 2 мм в качестве пограничного показателя позволило с точностью до 85 и 92,3 % диагностировать моно– и бихориальные двойни соответственно. Однако оценка этих параметров во многом зависит как от технических погрешностей, так и от гестационного срока на момент диагностики.
Оптимально для определения типа плацентации (хориальности) УЗИ в 6–9 недель беременности. В этот срок гестации при наличии бихориальной двойни определяется толстая перегородка, разделяющая 2 плодных яйца. После 9‑й недели беременности перегородка постепенно истончается, оставаясь толстой у основания и формируя к 10–14 неделям ультразвуковой признак (λ‑признак), который с высокой степенью достоверности позволяет проводить дифференциальный диагноз би– и монохориальной двойни. По мере прогрессирования беременности происходит регресс chorion laeve, и этот эхографический критерий становится менее доступным для исследования (в 10–14 недель – 100 %; в 16 недель – 98 %; в 20 недель – 87 %). Таким образом, отсутствие λ‑признака после 1620 недель беременности не может быть подтверждением монохориальности и, соответственно, не исключает возможность бихориальной (дизиготной) двойни. Напротив, наличие λ‑признака при ультразвуковом исследовании на любом сроке гестации свидетельствует о бихориальном типе плацентации. Следовательно, эхографический скрининг при многоплодной беременности в 11–14 недель с тщательным исследованием межплодовой перегородки с целью выявления λ‑признака необходим для ранней диагностики типа плацентации.
Помимо выявления типа хориальности (а в некоторых случаях и зиготности) УЗИ незаменимо для диагностики и определения тактики ведения пациенток при таких осложнениях многоплодной беременности, как задержка роста плода/плодов, синдром фето‑фетальной гемотрансфузии, внутриутробная гибель, структурные и хромосомные аномалии одного из плодов.
Течение многоплодной беременности нередко осложняется задержкой роста одного из плодов, частота которой в 10 раз выше таковой при одноплодной беременности и составляет 34 и 23 % соответственно при моно– и бихориальной двойне. Более выражена зависимость от типа плацентации частоты задержки роста обоих плодов – 7,5 % при монохориальной и 1,7 % при бихориальной двойне.
Характерная патология большого процента беременных с многоплодием – плацентарная недостаточность. ФПН – важнейшая проблема современной перинатологии, частота ее колеблется от 3–4 % до 45 %. Основные ее проявления – гипоксия и ЗРП, ведут к нарушению формирования плода или повреждению его ЦНС, сопровождаются снижением адаптации в раннем неонатальном периоде, а в последующем ведут к нарушению вазомоторного и интеллектуального развития детей.
Согласно определению А. П. Милованова, ФПН – это клинико‑морфологический симптомокомплекс, возникающей в результате сочетанной реакции плода и плаценты на различные нарушения состояния материнского организма. Некоторые авторы считают многоплодную беременность моделью плацентарной недостаточности (ФПН).
ХПН, сопровождающаяся гипотрофией плода, встречается при одноплодной беременности в 8,8 % случаев, а при многоплодной индуцированной беременности – более чем в 50 % случаев.
У женщин с самопроизвольно наступившей беременностью с дихориальным типом плацентации внутриутробная задержка роста плодов происходит почти в два раза реже (39,4 %), чем у беременных после ЭКО (67,7 %), индукции овуляции (66,7 %) и с монохориальным типом плацентации (68,0 %). Следствием плацентарной недостаточности являются различные варианты нарушения развития одного или обоих плодов‑близнецов. Установлено 5 типов развития близнецов из двойни по данным биометрии: I – физиологическое развитие (по сравнению с одноплодной беременностью) обоих плодов – у 17,4 % женщин; II – гипотрофия при недиссоциированном развитии обоих плодов – у 30,9 % женщин; III – диссоциированное (неравномерное) развитие плодов (при различии более чем на 10 % от массы тела большего плода) – у 35,3 % женщин; IV – врожденная патология развития плодов – у 11,5 % женщин; V – антенатальная гибель одного плода – у 4,1 % женщин.
Проведенные исследования показали, что при многоплодной беременности, продолжающейся более 36 недель, гипотрофия плодов наблюдается в 2 раза чаще, чем при сроках гестации 28–36 недель. В то же время признаки незрелости по отношению к гестационному возрасту после 36 недель беременности отмечаются в 5 раз реже. В связи с этим после 36 недель гестации возникает необходимость адекватной оценки состояния плодов‑близнецов, их зрелости, наличия и степени выраженности плацентарной недостаточности.
По данным М. А. Фукса, средняя масса плацент при двойне меньше, чем у женщин с одноплодной беременностью. Установлено, что морфологическая картина плацент близнецов существенно отличается от одноплодных плацент. Нормальное строение плацент установлено лишь у 4,6 % женщин, в 37,7 % случаев наблюдался вариант диссоциированного развития, характеризующийся наличием неравномерного созревания отдельных котиледонов. Морфометрическое исследование показало, что плаценты близнецов, рожденных первыми, отличались от плацент, рожденных вторыми, лучшей васкуляризацией.
Синдром фето‑фетальной гемотрансфузии (СФФГ), впервые описанный F. Schatz в 1982 г., осложняет течение 5‑25 % многоплодных однояйцевых беременностей. Перинатальная смертность при СФФГ достигает 60‑100 %. СФФГ, морфологическим субстратом которого являются анастомозирующие сосуды между фетальными системами кровообращения, – специфическое осложнение для монозиготной двойни с монохориальным биамниотическим типом плацентации, который наблюдается в 63–74 % однояйцевой многоплодной беременности. Вероятность возникновения анастомозов у монозиготных двоен с бихориальным биамниотическим типом плацентации (25–37 % однояйцевых двоен) не больше, чем у дизиготных двоен.
Проведенные анатомические исследования показали, что для СФФГ характерны артериовенозные анастомозы, располагающиеся не на поверхности, а в толще плаценты, и практически всегда проходящие через капиллярное ложе котиледона. Выраженность СФФГ (легкая, средняя, тяжелая) зависит от степени перераспределения крови через эти анастомозы, которые варьируют в размерах, числе и направлении. В некоторых случаях обнаружить коммуникантный сосуд позволяет эхография, диагностические возможности которой возрастают при использовании цветного допплеровского картирования и трехмерного ультразвукового сканирования.
Четкие механизмы, приводящие к развитию СФФГ у группы монохориальных двоен с сосудистыми коммуникациями, остаются недостаточно понятными. Предполагается, что основным пусковым фактором служит патология развития плаценты плода донора, в результате которой повышается периферическая резистентность плацентарного кровотока, что приводит к шунтированию крови к плоду‑реципиенту. Таким образом, страдание плода‑донора происходит в результате гиповолемии (вследствие потери крови) и гипоксии (вследствие плацентарной недостаточности). Плод‑реципиент компенсирует увеличение объема циркулирующей крови полиурией. При этом, учитывая, что содержание белков и клеточный состав остаются неизмененными, увеличение коллоидного осмотического давления приводит к чрезмерному поступлению жидкости из материнского русла через плаценту. В результате этого гиперволемия, полиурия и гиперосмоляльность приводят к сердечной недостаточности плода‑реципиента и многоводию.
Проведенные исследования кровотока при наличии СФФГ выявили отклонения допплерометрических показателей: увеличение пульсационного индекса в артериях пуповин у обоих плодов. У плода‑донора это обусловлено указанной выше патологией развития плаценты, у плода‑реципиента нарушение кровотока связывают с компрессией пуповины в результате многоводия. Вследствие плацентарной недостаточности у близнецов, хронической гипо– и гиперволемии соответственно у донора и реципиента нарушен и собственно плодовый кровоток в аорте и средней мозговой артерии.
Традиционно в течение многих лет диагноз СФФГ ставился ретроспективно в неонатальном периоде на основании разницы в содержании гемоглобина (50 г/л и более) в периферической крови близнецов и различия в массе новорожденных (20 % и более). Однако значительная разница в уровне гемоглобина и массе новорожденных характерна и для некоторых бихориальных двоен, и поэтому не патогномонична для СФФГ. Ультразвуковая диагностика тяжелой степени СФФГ, который сопровождается развитием многоводия, становится возможной в 16–24 недель беременности. Патогномоничными эхографическими признаками тяжелого СФФГ являются: наличие большого мочевого пузыря у плодареципиента с полиурией на фоне выраженного многоводия и «отсутствие» мочевого пузыря у плода‑донора с анурией, для которого характерно снижение двигательной активности на фоне выраженного маловодия.
При выявлении выраженного маловодия у одного плода и многоводия у другого при монохориальной беременности частота внутриутробной гибели обоих плодов составляет 90 %, что диктует необходимость более ранней диагностики этой патологии.
При тяжелом СФФГ ультразвуковые проявления гемодинамических изменений могут диагностироваться в 11–14 недель беременности и выражаются увеличением воротникового пространства у одного или обоих плодов. Возможно, что воротниковый отек у плода‑реципиента – проявление сердечной недостаточности в связи с гиперволемией. Наличие увеличенного воротникового пространства у монохориальных двоен в 11–14 недель беременности, хотя и не влечет за собой необходимости какого‑либо вмешательства, но требует тщательного наблюдения с целью ранней диагностики проявлений выраженного СФФГ. В 15–17 недель беременности возможно выявить СФФГ по наличию углубления‑складки межплодовых оболочек вследствие олигурии и коллапса амниотической полости плода‑донора.
Метод выбора для лечения СФФГ тяжелой степени – эндоскопическая лазерная коагуляция анастомозирующих сосудов плаценты под постоянным эхографическим контролем, так называемая «соно‑эндоскопическая» техника. Эффективность эндоскопической лазеркоагуляционной терапии СФФГ (рождение хотя бы одного живого ребенка) составляет 70 %. С помощью эндоскопической лазерной коагуляции возможно пролонгирование беременности в среднем на 14 недель и снизить смертность с 90 до 29 %.
Альтернативная тактика ведения беременных с выраженным СФФГ – традиционный метод лечения с помощью амниоцентезов и дренажа больших количеств амниотической жидкости. Это предотвращает риск выкидыша или преждевременных родов (до 32 недель). Пролонгирование беременности и как следствие снижение опасного воздействия гемодинамических нарушений (гипо– и гиперволемии), уменьшение внутриамниотического давления (тем самым компрессии, как правило, оболочечно прикрепленной пуповины и поверхностных сосудов плаценты) могут улучшить состояние кровотока как у плода‑донора, так и у плода‑реципиента. Эффективность амниодренажа, проводимого под ультразвуковым контролем, по данным различных авторов, составляет 30–83 %.
При гибели одного из плодов большое значение приобретает хориальность (больше, чем зиготность), которая позволяет в определенной мере прогнозировать перинатальный исход у второго из двойни. Частота монохориального типа плацентации при внутриутробной гибели одного из плодов составляет 50–70 %.
Только у 42,2‑68,5 % женщин после выявления в I триместре в полости матки нескольких плодных яиц наблюдалось рождение близнецов.
В раннем сроке беременности часть плодных яиц подвергается резорбции, прежде всего при анэмбрионии одного из плодных яиц. В большинстве наблюдений яйцо без эмбриона подвергается постепенной резорбции по мере прогрессирования беременности. Другой причиной несоответствия между количеством плодных яиц в начале беременности и числом многоплодных родов становится гибель одного из эмбрионов в ранние сроки, которая выявляется в 7‑10 % случаев и известна как феномен «исчезнувший близнец» (vanisning twin). Резорбция эмбриона происходит большей частью в течение первых 7 недель беременности.
Гибель одного из плодов возникает в любом сроке гестации, результатом этого может быть «отмирание» одного плодного яйца в I триместре, что отмечается в 20 % наблюдений с имплантацией более 1 эмбриона, и «бумажный плод» во II триместре беременности. Средняя частота гибели одного или обоих плодов на ранних сроках гестации составляет 5 % (2 % – при одноплодной).
При гибели одного из плодов во II–III триместрах беременности возможно преждевременное прерывание беременности вследствие выделения «мертвой» плацентой цитокинов и простагландинов. У 90 % беременных с двойней при внутриутробной гибели одного из плодов (при сроке гестации около 26 недель) происходит прерывание беременности в течение 3 недель после установления диагноза и, таким образом, недоношенность становится основной причиной неблагоприятного перинатального исхода для второго плода. ДВС‑синдром у матери как следствие всасывания тканей мертвого плода наблюдается редко и может развиться при пролонгировании беременности более чем на 5 недель.
Риск последующей гибели или повреждения головного мозга второго плода при внутриутробной гибели одного из двойни во II или III триместрах беременности при бихориальном типе плацентации составляет 5‑10 %, в то время как при монохориальности этот показатель достигает 25 %. Такой высокий процент неблагоприятного перинатального исхода автор объясняет тем, что при монохориальных двойнях, помимо недоношенности, огромный риск для живого плода представляют эпизоды выраженной гипотензии как следствия перераспределения крови («кровотечения») от живого плода в фетоплацентарный комплекс погибшего.
При внутриутробной гибели одного из двойни во второй половине беременности при монохориальном типе плацентации характерна более высокая частота неблагоприятных перинатальных исходов: мертворождение – 9,1 %; неонатальная смертность – 3,0 % и частота повреждения головного мозга – 15 % при общем проценте неблагоприятных исходов беременности 27,2 % (против 1,3; 5,2; 5,2 и 7,8 % соответственно при бихориальной двойне). Церебральный паралич с перивентрикулярной лейкомаляцией – доказанное и характерное осложнение монохориальной беременности и обычно становится следствием сосудистых нарушений у плодов (гипо‑, гиперволемия).
При гибели одного из плодов при бихориальной двойне оптимальна выжидательная тактика (при необходимости с использованием гепарина при пролонгировании беременности) с родоразрешением через естественные родовые пути. При монохориальной плацентации единственный выход для спасения жизнеспособного плода – это кесарево сечение, произведенное немедленно после гибели одного из плодов, когда еще не произошло повреждение головного мозга.
При выявлении врожденных пороков развития одного плода из двойни принципиальное значение имеет пренатальное определение зиготности, поскольку при однояйцевой двойне очень высока вероятность поражения обоих плодов, а при дизиготной второй плод может быть здоровым. Частота структурных аномалий развития плода при двуяйцевой двойне такая же, как при одноплодной беременности, в то время как при монозиготной – в 2–3 раза выше.
Мнения по поводу родоразрешения женщин с двойней при головном предлежании первого и тазовом предлежании второго плода противоречивы. Возможные альтернативы включают абдоминальное родоразрешение обоих плодов, роды через естественные родовые пути с извлечением за тазовый конец второго из двойни или наружный поворот второго плода с переводом его в головное предлежание под контролем ультразвукового исследования. Эффективность наружного поворота плода во время родов достигает 73 %.
Принимая во внимание, что родоразрешение через естественные родовые пути второго плода в тазовом предлежании массой менее 1500 г (с учетом возможных ошибок это соответствует при ультразвуковом исследовании 1800 г) сопровождается повышением неонатальной смертности и частоты внутрижелудочковых кровоизлияний, при неэффективности наружного поворота на головку целесообразным считается проведение кесарева сечения. У детей с массой более 1500 г (второй плод) достоверной разницы в перинатальном исходе в зависимости от метода родоразрешения не отмечается. При наличии опытного врача и предполагаемой массе второго плода более 1800 г (но меньше массы первого плода) допустимо извлечение за тазовый конец. Эта точка зрения имеет равное количество сторонников и противников: при извлечении за тазовый конец практически всегда происходит травматизация ребенка.
При многоплодной беременности особенно важно знать гестационный возраст плодов, который наиболее точно устанавливается при ультразвуковом исследовании в ранние сроки беременности. При определении срока родоразрешения при двойне следует учитывать, что беременность при двойне считается переношенной с 39‑й недели гестации.
Важное значение для определения тактики ведения родов имеет и четкое определение типа плацентации, поскольку при монохориальной двойне, наряду с высокой частотой антенатальной фето‑фетальной гемотрансфузии, существует высокий риск острой интранатальной трансфузии, которая может оказаться фатальной для второго плода (выраженная острая гиповолемия с последующим повреждением головного мозга, анемия, интранатальная гибель).
Наибольший риск в отношении перинатальной смертности представляют собой роды при монохориальной моноамниотической двойне, которая требует особенно тщательного ультразвукового мониторинга за ростом и состоянием плодов и при которой, помимо специфических осложнений, присущих монохориальным двойням, часто наблюдается перекрут пуповины. Оптимальным методом родоразрешения при этом типе многоплодия считается кесарево сечение в 33–34 недели беременности после документированной зрелости легких у плодов.
Исследования последних лет свидетельствуют, что осложнения родового акта у женщин с многоплодной беременностью возникают гораздо чаще, чем при одноплодной. Установлено, что несвоевременное излитие околоплодных вод и нарушение сократительной деятельности матки встречаются в 2 раза чаще, чем у женщин с одноплодной беременностью. Значительная площадь плаценты (плацент) способствует преждевременной ее отслойке, которая происходит в 2,4 % случаев.
По данным D. R. Lemery и соавт., острая гипоксия первого плода происходит у 5,7 % рожениц, а второго – в 5,2 % случаев. Частота гипотонических кровотечений в 3‑м периоде родов и раннем послеродовом периоде составляет 3–5 %. Обращает на себя внимание значительная частота травмы мягких родовых путей у родильниц после многоплодных родов, которая достигает 40 %.
С начала 80‑х гг. отмечено явное увеличение частоты абдоминального родоразрешения при многоплодной беременности; кесарево сечение при двойне производится в 40–50 % случаев. Неподготовленность родовых путей после 38 недель гестации и страдание плодов, тазовое предлежание обоих плодов у первородящих с отягощенным акушерским анамнезом, поперечное положение первого плода, по мнению отдельных авторов, являются показанием к кесареву сечению. Кесарево сечение при многоплодной беременности высокого порядка за последние 10 лет производят в 68 % случаев.
Неблагоприятный исход родов для матери и плода при многоплодии обусловлен не только невынашиванием беременности (незрелость плода), ее осложненным течением, но и недостаточно дифференцированным подходом к родоразрешению.
Некоторые авторы предлагают при многоплодной беременности после 32 недель и при тройне после 34 недель гестации в связи с риском развития антенатальной гибели плода, обусловленной нарастающей плацентарной недостаточностью, расширить показания к кесареву сечению. J. Pijnenborg и S. G. Oei подчеркивают, что установка на плановые абдоминальные роды не всегда лучше в сравнении с плановыми вагинальными родами. K. Ciach и соавт. считают идеалом родоразрешения многоплодной беременности кесарево сечение или программированные роды.
В последние десятилетия наблюдается определенное увеличение частоты кесарева сечения для извлечения второго близнеца после рождения первого плода вагинальным путем. J. Pijnenborg и S. G. Oei высказывают мнение, что это небесспорный метод, однако оправданный в чрезвычайных ситуациях, когда это единственный путь к щадящему окончанию родов.
В отношении метода родоразрешения пациенток с многоплодной беременностью тремя и более плодами точка зрения большинства акушеров сходится к плановому кесареву сечению в 34 недели.
Биологическая зрелость родовых путей Необходимость подготовки «незрелой» или «недостаточно зрелой» шейки матки не вызывает сомнений, поскольку в противном случае высок риск развития в родах аномалий родовой деятельности, повышения перинатальной заболеваемости и перинатальной смертности (рис. 7).
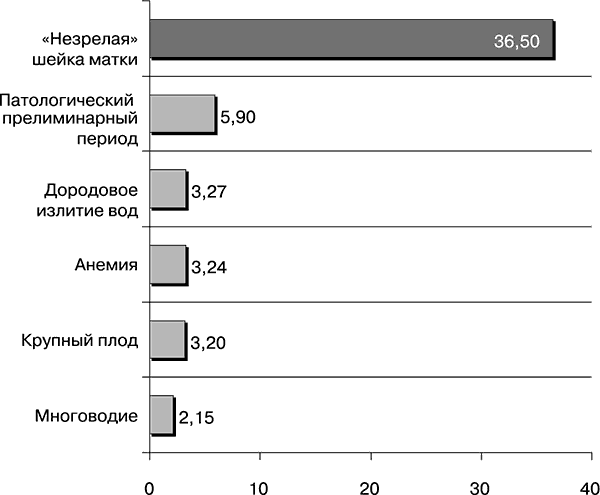
Рис. 7. Факторы риска развития аномалий родовой деятельности (отношения шансов)
Поэтому многие исследователи рассматривают степень «зрелости» шейки матки как важнейший критерий успешности предстоящих родов. Оценка шейки матки по шкале Bishop – более информативный и чувствительный показатель готовности организма беременной к индукции родов, чем УЗИ длины шейки матки, определение концентрации фетального фибронектина. Шкала Bishop широко используется во всем мире для оценки «зрелости» шейки матки и отличается простотой, удобством в практическом применении, высоким «уровнем согласия» при оценке состояния шейки матки разными акушерами.
Кроме того, шкала Bishop учитывает такой важный признак, как расположение предлежащей части плода по отношению к плоскостям малого таза. Важность учета данного признака подчеркивает исследование K. S. Shin, K. L. Brubaker, L. M. Ackerson: индукция или спонтанное начало родовой деятельности у первородящих в сроке 41 неделя гестации при головке плода, подвижной над входом в малый таз, повышает риск кесарева сечения в 12,4 раза по сравнению с первородящими, у которых головка плода прижата ко входу в малый таз.
По данным Н. В. Кузьминой оценивают незрелость родовых путей после полных 40 недель беременности в 4 балла перинатального риска.
Дата добавления: 2015-05-08; просмотров: 2407;
