Осложнения беременности
Токсикоз
Ранний токсикоз – одно из наиболее часто встречаемых осложнений гестационного процесса. Вследствие того, что такое проявление заболевания, как тошнота, встречается у большинства беременных, точная статистика встречаемости токсикоза неизвестна. В большинстве случаев заболевание протекает относительно легко, купируется соответствующим режимом и медикаментозной терапией, поэтому практикующие врачи на более поздних сроках зачастую забывают о его наличии и том спектре осложнений, которые могут ему сопутствовать в последующем. М. К. Кадыровым в 1999 г. изучен материал абортов, выполненных по медицинским показаниям у женщин с тяжелым токсикозом. Морфологически выявлена выраженная патология маточно‑плацентарной области, характеризующаяся снижением инвазивной активности интерстициального цитотрофобласта, практически отсутствовал внутрисосудистый компонент 1‑й волны инвазии и, соответственно, образовалось небольшое количество маточно‑плацентарных артерий с неполной гестационной перестройкой. Это объясняет тяжесть повреждения плаценты при токсикозе в виде несовершенного ангиогенеза, очаговой атрофии синцитиотрофобласта, отека или фиброза стромы ворсин. По мнению В. Е. Радзинского и А. П. Милованова, выявленные существенные изменения представляют собой инициальный этап развития гестозов, который у большинства беременных женщин купируется, но, вероятно, оставляет структурный «след» для последующего возникновения гестоза во II или III триместре, приводящий к дальнейшему повышению степени перинатального риска за счет прироста баллов (ранний токсикоз 2 балла, гестоз +2‑10 баллов).
Гестоз
В структуре причин материнской смертности 11–12 %. Беременность, осложненная гестозом, часто имеет неблагоприятные исходы и для плода. Уровень перинатальной заболеваемости колеблется от 64 до 78 %, а перинатальная смертность в 3–4 раза превышает средний показатель и составляет 18–30 ‰. Первое место в структуре ПС при гестозе принадлежит гипоксии плода, второе место занимают аномалии эмбриона и плода, далее идут внутриутробные инфекции, родовые травмы, гемолитическая болезнь плода и новорожденного. В Западной Европе примерно в 1/6 кювезов для интенсивной терапии новорожденных находятся дети от матерей с высоким артериальным давлением во время беременности. По данным ВОЗ, у каждого пятого ребенка, родившегося у матери с гестозом, в той или иной степени нарушено физическое и психоэмоциональное развитие, значительно выше уровень заболеваемости в младенческом и раннем детском возрасте. Высокая частота перинатальной патологии и перинатальной смертности связана не только с тяжелым течением гестоза, но и с высокой частотой преждевременных родов, которыми зачастую завершается беременность. В структуре причин преждевременных родов гестоз занимает 15 %.
Частота гестоза в Российской Федерации за последние десять лет повысилась с 18 до 21–23 %.
Российский ассоциацией акушеров‑гинекологов решено использовать термин «гестоз», в связи с этим приведено в соответствие название заболевания по МКБ‑10 с предложенным (табл. 8).
Для определения степени тяжести гестоза предлагается модифицированная шкала Г. М. Савельевой и соавт. (табл. 9).
Анализ зарубежной литературы и многолетние собственные наблюдения показывают, что наиболее серьезные осложнения для плода и матери, чья беременность осложнилась гестозом, возникают именно во время родов. Ситуацию зачастую осложняет поступление в родильные дома недообследованных рожениц, когда объективно оценить степень тяжести гестоза не всегда представляется возможным. Перинатальный подход к ведению родов и выбору метода родоразрешения у женщин с гестозом, нашедший свое отражение в значительном увеличении частоты абдоминального родоразрешения путем операции кесарева сечения, не принес ожидаемого результата. Практически не улучшились показатели детской заболеваемости и смертности, но резко возросли интра– и постоперационные осложнения.
Таблица 8 Классификация по МКБ‑10 и предлагаемая Российской ассоциацией акушеров‑гинекологов
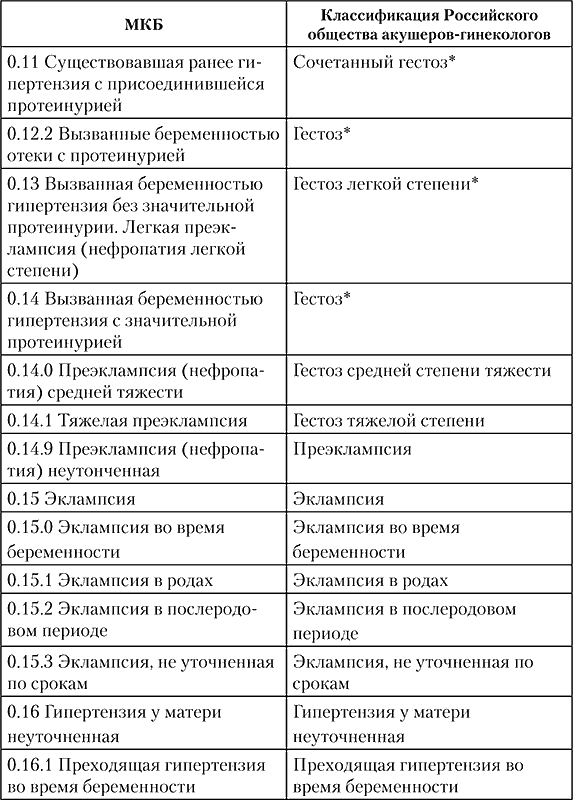
* Степень тяжести гестоза определяется по балльной шкале.
Таблица 9 Оценка тяжести гестоза беременных в баллах
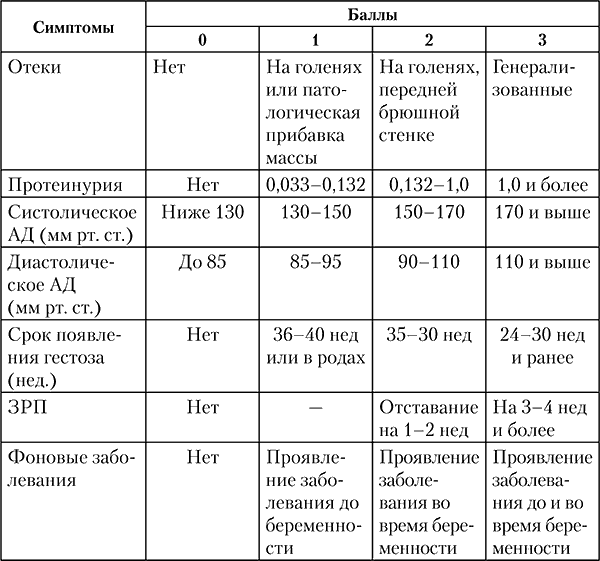
Примечание. До 7 баллов – легкая степень, 8‑11 баллов – средняя степень, 12 баллов и более – тяжелая степень.
Проблема гестоза неразрывно связана с таким тяжелым осложнением беременности, как плацентарная недостаточность и ЗРП. Данные об особенностях молекулярных и клеточных механизмов плацентарного гомеостаза и адаптационно‑гомеостатических реакций плаценты немногочисленны и разноречивы: недостаточно изучены регуляторные механизмы, обеспечивающие рост, структуру и функционирование всего ФПК при наиболее часто встречающейся патологии – гестозе. Длительно текущий гестоз оказывает неблагоприятное влияние на плаценту и плод. Но если в большинстве публикуемых работ сделаны выводы об ухудшении структурно‑метаболических характеристик ФПС при длительности гестоза 4–7 недель, то проведенные В. Е. Радзинским и соавт. исследования свидетельствуют об «истощении» молекулярных регуляторных механизмов адаптационно‑гемостатических реакций уже спустя 2–3 недели после установления диагноза нефропатии. Сдвиги в системе центральной и периферической гемодинамики, изменения реологических свойств крови, гемокоагуляции, микроциркуляции приводят к выраженным нарушениям маточно‑плацентарного кровотока и развитию ПН. Возникающие нарушения газообмена, транспорта питательных веществ и метаболизма приводят к ЗРП. При гестозе, по данным У. Р. Хамадьянова и Э. М. Галеева, средней степени тяжести частота ЗРП составляет 60 %.
Гестоз имеет различную балльную оценку перинатального риска в зависимости от тяжести течения. Отеки беременных – 2 балла, гестоз легкой степени – 3 балла, средней – 5 баллов, тяжелой степени – 10 баллов, преэклампсия и эклампсия – 11 и 12 баллов соответственно.
Плацентарная недостаточность Плацентарная недостаточность (ПН) – синдром, представляющий собой результат сложной поликаузальной реакции плода и плаценты, возникающий при самых различных патологических состояниях материнского организма. В его основе лежит нарушение компенсаторно‑приспособительных механизмов фетоплацентарного комплекса на молекулярном, клеточном, тканевом, органном и организменном уровнях, реализующееся в компенсированной, субкомпенсированной и декомпенсированной формах. ПН занимает ведущее место в структуре перинатальной патологии и смертности.
Многолетние наблюдения за развитием детей, рожденных пациентками с ПН, позволили В. Е. Радзинскому и П. Я. Смалько сделать вывод, что эта акушерская патология обусловливает не только существенное увеличение перинатальной смертности, но и лежит в основе многочисленных патологических изменений в организме ребенка, которые на протяжении первых лет жизни являются главной причиной нарушений его физического и умственного развития, повышенной соматической и инфекционной заболеваемости. В 1999 г. швейцарские исследователи опубликовали данные о влиянии ЗРП как следствия декомпенсированной ПН на длительность и качество жизни человека. Обследовав людей 1918‑1923‑х годов рождения в 1998 г., они установили, что маловесность при рождении как интегральный показатель внутриутробного неблагополучия – более значимый фактор недостаточной продолжительности жизни и болезненности во все возрастные периоды, чем гипертоническая болезнь, ожирение, алкоголизм, курение, низкий уровень социально‑экономических детерминант.
Еще в 1979 г. Е. П. Калашникова, М. В. Федорова доказали, что ПН обусловлена срывом компенсаторно‑приспособительных механизмов на тканевом уровне. Нами показано (Радзинский В. Е., 1983; 2001), что в патогенезе ПН решающая роль принадлежит молекулярным и клеточным изменениям. Дальнейшие исследования показали (Оразмурадов А. А., 2003), что развитие недостаточности плацентарного ложа и плаценты происходит в весьма ранние сроки беременности – до 16 недель при экстрагенитальных заболеваниях и до 12 недель при угрозе прерывания, особенно при сопутствующей соматической патологии.
С учетом времени начала по отношению к срокам формирования плаценты выделяют первичную и вторичную ПН.
Первичная ПН развивается в ранние сроки беременности (до 16 нед) в период имплантации, на ранних этапах развития плаценты и эмбриогенеза под влиянием генетических, эндокринных, инфекционных факторов, воздействия окружающей среды и др.
Вторичная ПН развивается уже при сформировавшейся плаценте. В ее генезе важную роль играют экстрагенитальные заболевания и осложнения беременности. По мнению различных авторов, основными звеньями в патогенезе ПН становятся нарушения маточно‑плацентарного и фетоплацентарного кровотока, недостаточность второй волны инвазии цитотрофобласта, патологическая незрелость ворсин.
Несмотря на огромное количество работ, посвященных изучению плаценты и ПН, проводимые на настоящем этапе антенатальные лечебные мероприятия при сопоставлении с вышеуказанными показателями перинатальной и младенческой заболеваемости оказываются малоэффективными, а зачастую и бесполезными, вследствие проведения их, как правило, лишь в III триместре беременности, на фоне сформировавшейся ПН. Перспективы дальнейших исследований связаны с расширением возможности диагностики состояния зародышевых и экстраэмбриональных структур с первых недель беременности, прогнозирования ПН, особенно при гестозе, раннее начало (до 17 недель) профилактических и лечебных мероприятий.
По данным А. А. Оразмурадова, прогнозировать и доклинически диагностировать недостаточность плацентарного ложа, лежащую в основе патогенеза первичной ПН, может определение:
• индекса пульсации в маточных, радиальных, спиральных артериях; сывороточного уровня лизосом, плацентарных протеинов (оценка состояния плацентарного ложа матки), начиная с ранних сроков беременности (6–7 недель);
• активности лизосомальных ферментов в сыворотке крови, отражающее состояние активности гидролаз в плацентарном ложе матки и плаценте;
• функциональной активности биомембран, в частности, эритроцитов, отражающее метаболизм липидов, их состав в мембранах клеток плацентарного ложа;
• уровня белков (ПАМГ, ТБГ).
Весьма перспективной представляется коррекция лизосомальных ферментов, регулирующих развитие клетки и ее программируемую гибель; коррекция микроциркуляции и трофики, наиболее раннее начало использования традиционных методов: полноценное, сбалансированное по ингредиентам и калоражу питание; сумма токоферолов; прокаротиноиды; транс– и параплацентарная оксигенация; коррекция микробиоценоза генитального тракта.
Задержка развития плода В 1961 г. Экспертный комитет по здоровью матери и ребенка рекомендовал считать низким вес новорожденных меньше 2500 г, независимо от гестационного возраста.
В литературе имеются указания о довольно большом диапазоне колебаний частоты выявления задержки развития плода (ЗРП) – от 3 до 40 %. В нашей стране популяционная частота ЗРП была оценена только в нескольких исследованиях, проведенных во второй половине 80‑х – начале 90‑х гг. Следует подчеркнуть, что из‑за отсутствия единых подходов к диагностике данные существенно различаются. Так, в исследованиях Г. М. Савельевой и соавт. популяционная частота ЗРП в одном из районов Москвы составила 4,1 %, а З. С. Ходжаева сообщает о 17,6 %, при этом автор основывается и на анализе результатов эпидемиологического популяционного исследования одного Московского региона. По данным Ч. Г. Гагаева, для пренатальной диагностики ЗРП помимо весо‑ростовых показателей необходимо учитывать и половую принадлежность плода – вес доношенных плодов мужского пола превышает таковой у плодов женского пола в среднем на 100–300 г (3‑10 % от массы тела плода при рождении). Статистически достоверные и клинически значимые межполовые различия по основным фетометрическим параметрам выявляются при ультразвуковом исследовании уже с начала II триместра беременности.
ЗРП оценивается в от 10 до 20 баллов в зависимости от степени. Она может сочетаться и с другой патологией плодного яйца. При изолированных врожденных пороках ЗРП отмечена в 14,2 %, при множественных пороках – в 27 % наблюдений (1990), в случаях предлежания плаценты – в 14 % случаев.
Многие авторы отмечают риск рождения маловесного ребенка у женщин, уже рожавших в прошлом детей с низкой или экстремально низкой массой тела – в 2–5 раз выше, чем у рожавших без ЗРП. Самопроизвольные аборты у них отмечаются в 2 раза чаще, чем в среднем в популяции, а преждевременные роды были в прошлом у каждой 10‑й (9,6 %) беременной. Риск рождения плода с ЗРП в 2 раза выше, если в прошлом были роды плодом с врожденными пороками развития или антенатальная гибель плода.
Нарушение роста и задержка развития органов плода приводят к возникновению дезадаптации в родовом процессе и сопровождаются отсутствием толерантности даже к непродолжительной гипоксии. Это может проявиться асфиксией у новорожденных (13 %); аспирацией околоплодных вод и мекония; гипертермией, не связанной с инфекционным процессом; перинатальной энцефалопатией; нарушением мозгового кровообращения (28 % новорожденных с ЗРП).
При патоморфологическом исследовании умерших детей с гипотрофией обнаруживали дистрофические процессы различной степени выраженности во всех органах, включая ЦНС. Нарушения морфогенеза были выражены гипоплазией внутренних органов; головного мозга; дисплазией костей; мелкими аномалиями (седловидная переносица, высокое нёбо, дефекты уха, раздвоение мечевидного отростка). Нарушения гидробаланса проявлялись повышением объема экстрацеллюлярной жидкости или эксикозом. Компенсаторно‑приспособительные процессы были представлены атрофией подкожно‑жировой клетчатки, увеличением веса селезенки (при тяжелой гипотрофии), полицитемией, повышением уровня фетального гемоглобина.
По данным A. Ashworth, у детей с весом при рождении 2000–2499 г. риск неонатальной смерти в 4 раза выше, чем у детей с весом 2500–2999 г и в 10 раз выше, чем у детей с весом 3000–3499 г. Риск постнеонатальной смерти у детей с весом при рождении 2000–2499 г повышается в 2 раза по сравнению с детьми с весом 2500–2999 г и в 4 раза по сравнению с детьми, весящими при рождении 3000–3499 г. Эти показатели не зависят от срока беременности, при котором произошли роды. Исследования доказали, что дети с низкими антропометрическими параметрами при рождении значительно чаще отстают в физическом (59 %) и психомоторном (31 %) развитии, чем дети с нормальными антропометрическими данными, у которых эти показатели составляют соответственно 6 и 3 %. D. Ley и соавт. провели анализ интеллектуального развития детей с задержкой внутриутробного развития. В ходе исследований ими была установлена четкая зависимость снижения интеллекта в раннем детстве от степени внутриутробных гемодинамических нарушений.
По данным Г. Я. Хотайт, с целью выявления контингента риска по развитию плацентарной недостаточности и ее ранних, доклинических стадий, рекомендуется в дополнение к другим методам обследования использовать определение у беременных женщин носительства аллеля PL‑AII гена GP IIIa в крови. При беременности, возникшей на фоне предшествующей экстрагенитальной патологии, наличие аллеля PL‑AII – 100 % прогностический признак неизбежности развития задержки роста плода, а при беременности, осложнившейся «чистым» гестозом, 75 % носителей аллеля PL‑AII гена GPIIIa угрожаемы по формированию задержки развития плода. Данный показатель может быть использован в качестве прогностического теста вне беременности и при положительном результате служить показанием для предгравидарной подготовки женщины, планирующей беременность. Маловодие Маловодие (олигогидрамнион) – это уменьшение объема околоплодных вод до 300–500 мл, связанное с нарушением процессов их секреции и обмена, которое отмечается в 0,3–0,4 % всех родов. Маловодие оценивается в 4 балла перинатального риска. При целенаправленной УЗ‑диагностике частота выявляемого хронического маловодия увеличивается в 10 раз и достигает 3–5 %.
Исследования, проведенные различными авторами, свидетельствуют о четкой зависимости между маловодием и частотой врожденных пороков развития плода: при их наличии этот показатель достигает 54 %.
При обнаружении маловодия во II триместре происходит, как правило, прерывание беременности на 18‑26‑й неделях. Давно замечена четкая зависимость между маловодием и ЗРП, а также между маловодием и высокой перинатальной смертностью или 100 % перинатальной заболеваемостью при их сочетании во II‑начале III триместров.
Выделяют следующие патогенетические варианты маловодия: • связанные с заболеванием матери (сахарный диабет, инфекционные и воспалительные заболевания);
• связанные с патологией плода (синдром фето‑фетальной гемотрансфузии, acardius‑acephalus, пороки развития ЦНС, ЖКТ, мочеполовой системы, легких, сердца, скелетные дисплазии, хромосомные аномалии и наследственные болезни (синдром Беквита‑Видемана и мн. др.), неопластические процессы, гематологические нарушения, внутриутробные инфекции, ГБП, неимунная водянка плода);
• связанные с патологией плаценты (хорионангиома, плацента, окруженная валиком (placenta circumvallata);
• идиопатическое многоводие (более чем в 60 % случаев причины многоводия остаются невыясненными).
F. A. Manning и соавт. установили, что при задержке внутриутробного роста плода в 89 % наблюдений объем околоплодных вод уменьшается. По нашим данным сочетание маловодия и гипотрофии плода диагностируется в 86 % случаев. Для новорожденных, родившихся от матерей с выраженным маловодием, характерно снижение адаптационных возможностей. По данным L. I. Mercer и соавт., при уменьшенном объеме околоплодных вод частота дистресса у плода во время родов составляет 10 %, a B. G. Du Masgenet установил, что у новорожденных, родившихся от матерей с маловодием, возрастает в 5 раз риск внутриутробного инфицирования. Внутриутробное инфицирование отмечается в 1,62 % наблюдений, пневмопатия – в 4,9 %.
Принято выделять две формы маловодия:
• раннюю, диагностируемую с помощью УЗИ в сроки 16–20 недель. Она обусловлена функциональной несостоятельностью плодных оболочек;
• позднюю, выделяемую обычно после 20‑й недели беременности, когда маловодие наступает вследствие гидрорреи из‑за частичного дородового разрыва плодных оболочек. Встречается в 24 % всех наблюдений маловодия. Однако дифференциальная диагностика раннего и позднего маловодия возможна только при ультразвуковом исследовании в динамике беременности.
Наиболее плохой прогностический признак исхода беременности для плода – развитие маловодия во II триместре беременности. В случае сочетания выраженного маловодия с задержкой развития плода общая перинатальная смертность увеличивается со 132 до 187,55 ‰, а редуцированная – с 17,7 до 109 ‰. Учитывая крайне высокий перинатальный риск у беременной с ЗРП на фоне выраженного маловодия (4 балла + 20 баллов = = 24 балла – высокий риск!), необходимо решить вопрос о целесообразности дальнейшего пролонгирования беременности.
Если маловодие возникло или диагностировано при сроке беременности после 28 недель, показано комплексное обследование (гормональное, биохимическое, ультразвуковое) для определения состояния фетоплацентарного комплекса. При сочетании маловодия в III триместре беременности с задержкой роста плода исход беременности остается проблематичным. При маловодии, развившемся в III триместре беременности, без нарушения роста плода, при правильном ведении беременной возможен благополучный исход родов.
Многоводие Многоводие (полигидроамнион) – увеличение объема околоплодных вод более 2000 мл. Развивается как своеобразная водянка плодовместилища в течение II и III триместров беременности и подразделяется на хроническую и острую формы. Многоводие встречается примерно у 0,6–0,7 % беременных и оценивается в 3 балла перинатального риска.
Острое многоводие встречается крайне редко. Наблюдается при монозиготной двойне, но значительно чаще при инфекционных заболеваниях, особенно вирусных, и развивается при сроке беременности 16–24 недель.
Этиологическими факторами многоводия являются сахарный диабет, инфекционные заболевания, изосерологическая несовместимость крови матери и плода, пороки плода, многоплодная беременность.
Первое место среди причин многоводия занимает сахарный диабет (24,6 %), затем пороки развития плода (19,8 %), эритробластоз плода (11,5 %), многоплодная беременность (8,4 %).
При многоводии часто возникают пороки развития плода – поражение центральной нервной системы, атрезии верхнего отдела пищеварительного канала, поликистоз почек, легких, нарушение нормального процесса секреции и резорбции вод. Так, одни авторы считают, что при анэнцефалии нарушается процесс глотания, при атрезии пищевода – процесс продвижения жидкости по пищеварительному каналу; при патологии легких повышается продукция жидкости легочной тканью. Многоводие часто становится причиной внутриутробного поражения и развития порока сердца.
Сложно ответить на вопрос, что первично: пораженный плод или причина, приведшая к его поражению, одновременно вызывает развитие многоводия. По‑видимому, более вероятно второе предположение, поскольку закладка органов плода происходит в первые 3 месяца беременности, а многоводие в большинстве случаев возникает позже.
Частым осложнением многоводия, особенно острой его формы, становятся поздние аборты и преждевременные роды. По данным Н. Г. Кошелевой и М. А. Ярцевой, угрожающее невынашивание беременности встречается в основном в сроки беременности до 12 и после 23 недель. Авторы считают, что возникновение угрозы невынашивания беременности в I триместре можно объяснить действием той же причины, которая привела к многоводию. Рецидив угрозы этой патологии во II и III триместрах объясняется нарушением адаптации матки к увеличенному количеству околоплодных вод.
Преждевременное прерывание беременности отмечено нами у 28,4 % женщин с многоводием. Частота преждевременных родов составила 21,1 %, поздних выкидышей – 7,3 %. Резкое увеличение числа случаев неправильного положения и предлежания плода – одна из характерных клинических особенностей многоводия.
Слабость родовой деятельности развивается, по данным различных авторов, в 16–21,9 % случаев, что можно объяснить снижением сократительной способности матки в связи с длительным перерастяжением ее стенок за счет избыточного накопления околоплодных вод. Частота преждевременного и раннего излития околоплодных вод при многоводии колеблется от 13,8 до 15 %. По нашим данным, этот показатель у беременных с нормальным содержанием околоплодных вод составляет 14,3 %, что не позволяет согласиться с существующим мнением о важной роли многоводия в этиологии преждевременного и раннего излития околоплодных вод.
По нашим данным, общая и редуцированная перинатальная смертность при увеличенном объеме околоплодных вод равны соответственно 32,9 и 4,12 %. Причиной антенатальной и интранатальной смерти в большинстве случаев становится гипоксия плода.
У новорожденных, родившихся от матерей с многоводием, часто развивается пневмопатия как за счет внутриутробного инфицирования, так и вследствие аспирационного синдрома. При многоводии увеличивается рождаемость маловесных детей в результате частого преждевременного прерывания беременности и задержки внутриутробного роста плода, развивающегося на фоне выраженного многоводия. Одновременно с этим при многоводии, развившемся на фоне гипергликемии, повышается частота рождения плодов с массой тела более 4000 г.
Перенашивание По данным литературы, перенашивание встречается с частотой 4‑14 % от общей популяции. Однако если ориентироваться на гестационный срок, определяемый по УЗИ в I триместре, то частота истинного перенашивания (42 и более недель) составляет только 1–3 %. С другой стороны, следует понимать, что если бы врачи не ставили себе задачу родоразрешить беременных после 40 недель, число случаев истинного перенашивания было бы больше. Перинатальная смертность при перенашивании повышена, причем в структуре ПС превалируют интранатальная и неонатальная смертность. При перенашивании чаще встречается синдром аспирации мекония. У детей, рожденных после 41‑й недели, в 2–5 раз чаще встречаются выраженные поражения ЦНС. Частота рождения крупных плодов достигает 30 %, что вносит свою лепту в повышение частоты осложнений при родоразрешении.
Перенашивание следует расматривать как результат взаимодействия многих факторов, однако ведущее значение принадлежит нейрогуморальной регуляции. Переношенная беременность протекает на фоне многочисленных факторов, оказывающих неблагоприятное влияние на репродуктивную функцию женщины:
• позднее половое созревание;
• нарушение менструальной функции;
• инфантилизм;
• перенесенные ранее детские инфекционные заболевания;
• нарушения обмена веществ;
• эндокринные заболевания;
• воспалительные заболевания половых органов;
• психические травмы;
• гестозы;
• нарушения гипофизарно‑надпочечниковой системы плода;
• указания на перенашивание беременности в анамнезе.
Ведущее значение в нейрогуморальной регуляции функционального состояния матки, включая и родовую деятельность, имеют гипоталамус и структуры лимбического комплекса, в первую очередь миндалевидные ядра и корковые образования, расположенные в височных долях больших полушарий. В наступлении беременности, ее течении, развитии и характере родовой деятельности большая роль принадлежит эстрогенам, гестагенам, кортикостероидам, хорионическому гонадотропину, некоторым тканевым гормонам (ацетилхолину, катехоламинам, серотонину, кининам, гистамину, простагландинам), энзимам, электролитам, микроэлементам и витаминам.
При нормальной беременности наблюдают нарастание уровня эстрогенов вплоть до ее конца. Уровень эстриола нарастает особенно быстро после 32 недель беременности. Установлено, что эстрон и эстриол играют важную роль в подготовке организма беременной к родам. Самая высокая концентрация эстрогенов наблюдается во время родов. Считается, что уровень эстрогенов играет важную роль в наступлении родов, но они не являются пусковым фактором этого процесса. Синтез эстриола осуществляет фетоплацентарная система. Он начинается с дегидроэпиандростерона (ДГЭА) в надпочечниках плода, который в его печени гидролизуется в 16‑ДГЭА, а в плаценте превращается в эстриол. Только небольшое количество ДГЭА и 16‑ДГЭА образуется в организме матери. Установлено, что аномалии развития плода, особенно ЦНС с выраженными поражениями надпочечников, ведут к перенашиванию беременности. Таким образом, можно сделать вывод, что причина переношенной беременности нередко связана с плодом и плацентой, а не с первичной инертностью материнского организма.
Изменения, наблюдаемые в плаценте при переношенной беременности, по‑видимому, являются вторичными. Однако в дальнейшем они могут играть важную роль в стероидогенезе, состоянии плода и возникновении родовой деятельности. Развивающаяся ПН приводит к нарушению обмена веществ у плода, а снижение жизнеспособности плода отрицательно отражается на функции плаценты. Так создается круг патологических процессов, присущих переношенной беременности.
У женщин, указывающих на перенашивание предыдущей беременности, вероятность перенашивания в последующем составляет 19,9 %, в то время как у женщин, родоразрешившихся в срок, – 7,7 %.
При перенашивании повышен риск перинатальной заболеваемости и смертности. Кроме того, по мере увеличения гестационного срока отмечается экспоненциальный рост осложнений для матери, плода и новорожденного. J. Nakling, B. Backe установили, что среди детей, рожденных в сроки 37 недель, перинатальная смертность составляет 0,2 %, тогда как в сроки 42 недели и более ее уровень достоверно возрастает, составляя 3,7 %.
К характерным осложнениям родового акта при перенашивании относят острую и хроническую гипоксию, родовую травму при макросомии, аспирацию мекониальными водами.
K. Lindstrom и соавт. показали, что дети дошкольного возраста (4–5,5 лет), рожденные переношенными, отстают в развитии от своих сверстников, рожденных доношенными, при этом у мальчиков отклонения в нейропсихическом развитии выражены сильнее по сравнению с девочками. Перенашивание беременности оценивается в 3 балла перинатального риска, но при развитии осложнений родов обязательно следует учитывать интранатальный прирост баллов для своевременного решения вопроса об абдоминальном родоразрешении у рожениц с высоким перинатальным риском. Аномалии родовой деятельности По данным А. Д. Подтетенева, аномалии родовой деятельности наблюдают у 9,4 % рожениц. При этом слабость родовой деятельности встречается в 5,6 % родов, дискоординация родовой деятельности – 1,7 %, бурная родовая деятельность – 2,1 %.
С позиций перинатального акушерства рациональная коррекция гипо– и гипертонических маточных сокращений, а главное своевременный отказ от проведения утеротонической терапии, приобретают особую важность.
В большинстве случаев и сами аномалии родовой деятельности, и проводимые терапевтические мероприятия вызывают нарушения функционального состояния плода в родах, выраженность которых индивидуальна в каждом конкретном случае.
Координированная сократительная деятельность матки обеспечивает устойчивость плода к родовому стрессу, оптимальный уровень метаболических процессов в фето‑плацентарной системе, способствует поддержанию нормального маточно‑плацентарно‑плодового кровотока. По данным И. О. Макарова, даже при физиологической родовой деятельности маточно‑плацентарный и плодово‑плацентарный кровоток изменяется в зависимости от фаз сокращения матки: наибольшее его снижение наблюдается в маточных артериях на «пике» схватки, а в артериях пуповины – при нарастании силы сокращения матки. При дискоординированной сократительной деятельности матки маточно‑плодово‑плацентарный кровоток страдает в большей степени, чем при слабой, что связано с более интенсивным характером схваток при дискоординации родовой деятельности, преобладанием продолжительности систолы схватки над диастолой, неполным расслаблением матки между схватками.
При аномалиях родовой деятельности более половины родов осложняются острой гипоксией плода, а у каждого третьего новорожденного от матери с дискоординацией родовой деятельности наблюдается гипоксически‑ишемическое поражение ЦНС.
На современном этапе наиболее эффективным методом профилактики аномалий родовой деятельности является своевременное устранение нерегулярных, длительных, болезненных предродовых сокращений матки, не приводящих к структурным изменениям шейки (патологический прелиминарный период). По данным исследования А. Д. Подтетенева, внедрение концептуальной схемы лечения патологического прелиминарного периода, включающей акушерский сон с параллельным введением экзогенных агонистов и/или сенсибилизаторов β2‑адренорецепторов, статистически значимо снижает частоту развития аномалий родовой деятельности с 46,6 % при традиционной тактике (акушерский сон) до 24,8 %. Сложным является вопрос о влиянии методов коррекции аномалий родовой деятельности на состояние плода. С одной стороны, данные мероприятия нужны для нормализации сократительной деятельности матки и обеспечения прогресса родов, с другой – необходима оценка фармакологического воздействия на плод.
Что касается влияния методов лечения дискоординации родовой деятельности на состояние плода и ново рожденного, то ряд авторов констатируют благоприятное воздействие эпидуральной анестезии, отмечая повышение двигательной активности плода, снижение дыхательной активности на 20 %, повышение оценки новорожденных по шкале Апгар. А. А. Жежер выявил снижение оценки новорожденных по шкале Апгар при предоставлении лечебного акушерского наркоза (натрия оксибутират и наркотические анальгетики) в I периоде родов при ярко выраженной дискоординированной сократительной деятельности матки, чего не наблюдалось при проведении данных лечебных мероприятий по поводу патологического прелиминарного периода, рассматриваемого как I стадия дискоординации сократительной деятельности матки.
При развитии аномалий родовой деятельности происходит прирост риска за счет интранатальных факторов, которые могут суммироваться (дискоординация, осложнившаяся слабостью). У беременных группы высокого перинатального риска целесообразно расширять показания к абдоминальному родоразрешению. В «Национальном руководстве по акушерству» роды, осложнившиеся аномалиями родовой деятельности, рекомендовано закончить путем операции кесарева сечения в следующих случаях:
• отягощенный акушерский анамнез (длительное бесплодие, невынашивание беременности, неблагоприятный исход предыдущих родов);
• сопутствующая соматическая и экстрагенитальная патология;
• возраст первородящей старше 30 лет;
• отсутствие эффекта от проводимой терапии.
Дата добавления: 2015-05-08; просмотров: 2326;
