Температура взрыва
До сих пор мы говорили о химических реакциях, протекавших при постоянной температуре. Но на практике, чаще всего, в процессе горения или взрыва температура меняется, причем весьма значительно. Как рассчитать разогрев газа, в котором происходит экзотермическая химическая реакция?
Естественно, температура газа будет зависеть от того, отводится тепло или нет, совершает газ работу расширения или находится в постоянном объеме. Ограничимся лишь случаем адиабатного процесса, то есть идущего без обмена теплом с окружающей средой.
Пусть протекает химическая реакция:
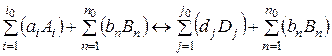
Здесь Ai – химически активные в данной реакции вещества;
Bn – химически пассивные в данной реакции вещества;
Dj – продукты реакции;
i0, n0, j0 – количество компонентов: активных, пассивных и продуктов реакции;
ai, bn, dj – количество молей активных, пассивных веществ и продуктов реакции.
Пример: реакция горения водорода в воздухе. Химически активные вещества – H2 и O2, химически пассивные – N2, Ar, CO2 и другие компоненты воздуха, продукт реакции – H2O.
Если одно из химически активных в данной реакции веществ имеется в избытке, то избыточную часть его можно отнести к химически пассивным веществам.
Согласно 1-го закона термодинамики
dQ = dI – V dp.
Если реакция протекает при p = const, то dp = 0. Если процесс адиабатный, то и dQ = 0. Следовательно, в таком процессе dI = 0, то есть I = const или I2 = I1, где I1 – энтальпия системы до реакции, а I2 – энтальпия системы после реакции.
Если справедливы законы идеального газа, то
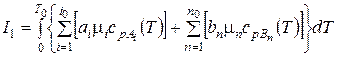 ,
,
a
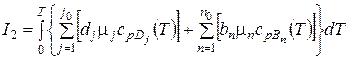 .
.
Вычислить с достаточной точностью эти значения энтальпии весьма сложно, так как необходимо знать характер функций теплоемкостей от температуры, причем в интервалах от 0 °K до T0 или T. В этих диапазонах происходят фазовые переходы и зависимость сp(T) носит весьма сложный характер. Поэтому эту сложность обойдем.
Рассмотрим ту же реакцию, но протекающую при (p, T) = const. В этом случае реакция будет сопровождаться тепловым эффектом
Qp = DI ' = I '2 – I '1.
Но исходное состояние системы в обеих реакциях одинаково, то есть
I1 = I '1,
тогда
I2 = I '1 = I '2 – Qp.
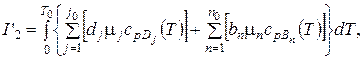
следовательно
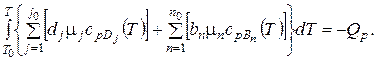
Введем средние мольные теплоемкости конечных продуктов реакции на интервале от T0 до T:
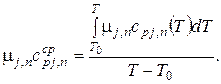
Средняя мольная теплоемкость всех конечных продуктов реакции:

где
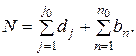
Тогда
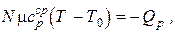
отсюда

Данный расчет температуры горения носит приближенный характер и приводит к ее завышению, потому что не учитывает характера химического равновесия при высокой температуре, а именно, диссоциацию продуктов горения на более простые соединения, которая идет с поглощением значительного количества тепла.
Чем выше температура и ниже давление горения, тем более грубый результат дает эта методика. Так, для горения гремучей смеси (смеси H2 и O2) получается температура более 7000 °K, а для горения твердого углерода в кислороде – почти 12000 °K, то есть получаются температуры, при которых газ уже не существует (это температуры плазмы). На самом деле температуры горения кислородных смесей лежат в интервале 3000 – 4000°K. Для случая горения в воздухе ошибки будут значительно меньше.
Как более точно рассчитать температуру горения?
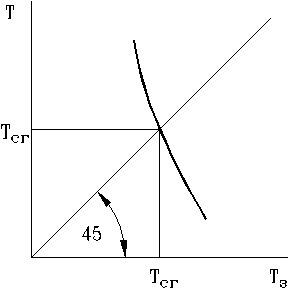
Надо задаться температурой Tз и по исходному составу реагирующей смеси и Tз определить константу равновесия Kp, по ней вычислить степень диссоциации a. По a уточнить тепловой эффект Qp и 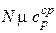 , вычислить температуру T. Естественно, она не совпадет с Tз, поэтому следует проделать эту процедуру несколько раз, результаты нанести на график и соединить точки плавной кривой.
, вычислить температуру T. Естественно, она не совпадет с Tз, поэтому следует проделать эту процедуру несколько раз, результаты нанести на график и соединить точки плавной кривой.
Там, где кривая пересечет луч, проведенный под углом 45°, и лежит значение температуры сгорания.
Для случая адиабатной реакции при V = const все остается в силе, только следует вместо сp подставлять сV. Так можно найти температуру взрыва.
Другой метод определения температуры взрыва – табличный (по таблице внутренних энергий продуктов взрыва, рассчитанных для широкого диапазона температур). Расчет ведется по формуле:

где 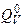 – теплота взрыва, приведенная к 0°С;
– теплота взрыва, приведенная к 0°С;
ni – число грамм-молей i-го продукта взрыва;
DUi – изменение внутренней энергии i-го продукта взрыва в интервале температур 0°С – t°C [ 2, стр.106 ].
Последовательность вычислений следующая. Определяется теплота взрыва 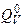 . По таблице для принятой температуры t вычисляется суммарное изменение внутренних энергий. Естественно, их значения не совпадут. Повторяют расчет 1, 2 и т.д. раз, пока не найдут вилку температур в таблице, где лежит теплота взрыва. Далее, пользуясь линейной интерполяцией, находят приближенное значение температуры взрыва.
. По таблице для принятой температуры t вычисляется суммарное изменение внутренних энергий. Естественно, их значения не совпадут. Повторяют расчет 1, 2 и т.д. раз, пока не найдут вилку температур в таблице, где лежит теплота взрыва. Далее, пользуясь линейной интерполяцией, находят приближенное значение температуры взрыва.
Для приближенного определения теплоемкостей можно воспользоваться эмпирическими формулами, полученными М.П. Вукаловичем и В.А. Кириллиным для некоторых газов (средние мольные теплоемкости в интервале температур от 0°С до t°C).
| Газ | 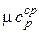 [Дж/(моль×град)] [Дж/(моль×град)]
|
| N2 | 28,97+0,002566×t |
| H2 | 28,78+0,001117×t |
| O2 | 29,56+0,003404×t |
| CO | 29,06+0,002818×t |
| Воздух | 28,09+0,002412×t |
| H2O(г) | 32,85+0,00544×t |
| CO2 | 36,05+0,0203×t+0,00000642×t2 |
Примечание: t подставляется в °С.
Существуют формулы Каста для средних мольных теплоемкостей при постоянном объеме в интервале температур от 0 °С до t °C:
| Газ | 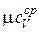 [кал /(моль×град)] [кал /(моль×град)]
|
| двухатомные газы | 4,8+0,00045×t |
| пары воды | 4,0+0,00215×t |
| углекислый газ | 9,8+0,00058×t |
| четырехатомные газы | 10,0+0,00045×t |
| пятиатомные газы | 12,0+0,00045×t |
Примечание: t подставляется в °С. Для перевода в СИ табличное значение следует умножить на 4,184.
Сравнение с методом расчета температуры взрыва по внутренним энергиям показывает, что теплоемкости по Касту получаются несколько заниженные, и, следовательно, температуры взрыва – завышенные.
Дата добавления: 2015-03-03; просмотров: 1606;
