Степенью диссоциации a называется доля моля конечного вещества реакции, разложившегося к моменту равновесия на исходные вещества.
Например, горение водорода выражается формулой:
H2 + 0,5O2 « H2O.
Если сгорание полное, то из 1 моля водорода и 0,5 моля кислорода образуется 1 моль водяного пара. Но вследствие термической диссоциации к моменту равновесия будет не 1 моль пара, а только (1 – a) моль, но зато будет a моль водорода и 0,5a моль кислорода.
Другими словами, степень диссоциации a тоже связана с константой равновесия. Установим эту связь.
а) Реакции горения, протекающие с уменьшением числа молей, например:
H2 + 0,5O2 « H2O(г).
К моменту равновесия состав продуктов сгорания следующий:
| H2O(г) | (1 – a) моль |
| H2 | a моль |
| O2 | 0,5a моль |
 Всего Всего
| 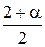 моль моль
|
Найдем парциальные давления:
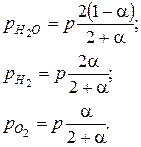
Найдем константу равновесия:
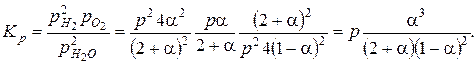
Для определенной температуры Kp имеет вполне определенное значение, поэтому степень диссоциации зависит от давления p.
Разделим числитель и знаменатель на a3:
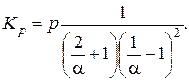
K p от p не зависит, следовательно, от давления зависит a. Чем больше p, тем меньше дробь, то есть меньше a. Таким образом, при T = const и повышении давления степень диссоциации будет уменьшаться, реакция будет протекать полнее.
б) Реакции, протекающие без изменения числа молей, например:
CO + H2O « CO2 + H2.
Состав смеси в момент равновесия:
| СO2 | (1 – a) моль |
| H2 | 1 – a) моль |
| CO | a моль |
| H2O | a моль |
| Всего | 2 моль |
Константы равновесия:
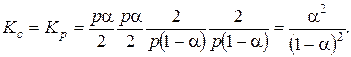
Как мы видим, в выражение для Kp не входит давление, то есть при T = const Kp = const, а значит и a = const. Степень диссоциации в данном случае не зависит от давления.
Как видно из этих примеров, связь между Kp и a существует, но для разных реакций она различная, причем a зависит от давления, а Kp –не зависит, поэтому в практических расчетах пользуются константой равновесия Kp. Для нее составлены таблицы для различных реакций в зависимости от температуры.
Температурная зависимость константы равновесия Kp следующая:
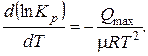
Эта зависимость одинакова и для изохорно-изотермической и для изобарно-изотермической реакций, надо только подставлять соответственно QV или Qp.
Анализируя формулу, увидим, что для экзотермических реакций (с выделением тепла) Q max < 0 (то есть тепло отводится от системы)
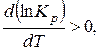
то есть d(ln Kp) и dT имеют одинаковые знаки. Это означает, что при повышении температуры (dT > 0) растет ln Kp, а значит и Kp, то есть увеличиваются парциальные давления исходных веществ и снижаются парциальные давления продуктов реакции, другими словами, равновесие сдвигается влево, реакция проходит менее полно, увеличивается степень диссоциации.
Как мы убедились, состояние равновесия подвижно. Оно зависит от внешних воздействий на систему. Влияние таких внешних воздействий на равновесие системы сформулировал Ле-Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Такими внешними воздействиями могут быть изменения температуры, давления, концентрации исходного вещества или продукта реакции. Этот принцип имеет очень большое значение. Он позволяет с помощью внешних воздействий изменять равновесный состав в зависимости от потребностей, то есть управлять реакцией.
Дата добавления: 2015-03-03; просмотров: 747;
