Равновесие в химических реакциях
В общем случае химическая реакция может быть записана следующим образом:
a×A + b×B « с×С + d×D,
где a, b, c, d – числа молей (стехиометрические коэффициенты).
Химическая реакция не протекает до полного исчезновения исходных веществ, а останавливается при достижении определенного состояния химического равновесия.
Обозначим через j A, j B, j C, j D химические потенциалы веществ при равновесии.
Условие равновесия при (p, T) = const: dF = 0.
F = Gj,
тогда
dФ = G dj +j dG = G d(u – sT + pv) + j dG =
= G du – G d(sT) + G d(pv) + j dG =
= G (T ds – p dv) – Gs dT – GT ds + Gp dv + Gv dp + j dG =
= GT ds – Gp dv – S dT – GT ds + Gp dv + V dp + j dG =
= – S dT + V dp + j dG = 0
При (p, T) = const dT = 0 и dp = 0, следовательно
dF = j dG = 0.
Если в системе смесь веществ, то
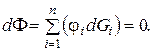
Тогда для реакции a×A + b×B « с×С + d×D,
dF =jC mC dnC + jD mD dnD – jA mA dnA – jB mB dnB = 0,
где m i – молекулярные массы веществ;
n i – числа молей веществ.
Уравнение можно переписать через стехиометрические коэффициенты реакции
jC mC c + jD mD d– jA mA a–jB mB b= 0.
Если к веществам применимы законы идеальных газов, то
j i = j oi + RiT ln pi,
и уравнение примет следующий вид:
(c joC mC + d joD mD – a joA mA – b joB mB) +
+mRT(c ln pC + d ln pD – a ln pA – b ln pB) = 0.
Отсюда
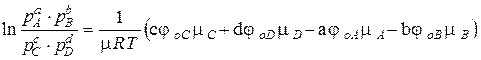
Так как правая часть уравнения при T = const постоянна, то и левая должна быть постоянной. Обозначим ее ln K p:
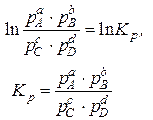 Это так называемый закон действующих масс.
Это так называемый закон действующих масс.
K p – это константа равновесия химической реакции по парциальным давлениям.
Константу равновесия можно выразить через концентрации веществ. Концентрация вещества – это количество молей вещества в 1 м3.
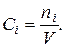
Для идеальных газов концентрацию можно выразить через парциальное давление
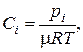
то есть
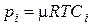
тогда
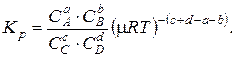
Обозначим
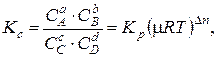
где Dn = (c+d) – (a+b).
K c – константа равновесия химической реакции по концентрациям.
Если число молей в реакции не изменяется, то есть Dn = 0, то K p = K c.
Закон действующих масс определяет и скорости протекания реакций (он справедлив не всегда, но достаточно часто):
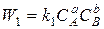 – скорость прямой реакции;
– скорость прямой реакции;
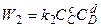 – скорость обратной реакции.
– скорость обратной реакции.
Здесь k1 и k2 – константы скорости прямой и обратной реакций.
Отсюда видно, что если в реакции установилось равновесие, то есть W1 = W2, то
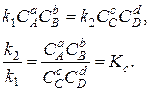
Константа равновесия связана с максимальной работой L*max:
L*max = – mRT ln K p,
или, учитывая значение универсальной газовой постоянной mR и коэффициента, связывающего натуральный и десятичный логарифмы:
L*max = – 19,15T lg K p.
При высоких температурах наблюдается разложение сложных веществ на более простые. Это явление называется термической диссоциацией. Например,
2H2O « 2H2 + O2;
2H2O « 2HO + H2;
2CO2 « 2CO + O2.
При температурах более 2500 °С двухатомные газы разлагаются на одноатомные:
О2 « 2О;
H2 « 2H;
N2 « 2N.
Реакции диссоциации – эндотермические реакции, то есть протекают с поглощением тепла. Диссоциация конечных продуктов сгорания указывает на неполноту реакции, на неполноту выделения теплоты и, следовательно, снижает к.п.д. камеры сгорания двигателя.
Дата добавления: 2015-03-03; просмотров: 714;
