Скорость химической реакции
По ходу рассмотрения константы равновесия мы уже упоминали о скорости химической реакции и определяли
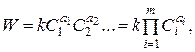
где ai – cтехиометрические коэффициенты реакции;
m – число исходных веществ реакции;
k – константа скорости реакции (функция температуры).
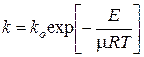 – соотношение Аррениуса.
– соотношение Аррениуса.
ko – предэкспоненциальный множитель, вычисляется методами кинетической теории газов (он хотя и меняется с температурой, но незначительно, поэтому в инженерных расчетах его можно принимать постоянным);
E – энергия активации, то есть та энергия, которую молекулы тратят на преодоление устойчивых химических связей.
Константа скорости реакции зависит от температуры очень сильно. Так при E = 40 ккал/моль (167,36 кДж/моль) и T = 500 °K
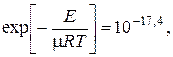
а при T = 1000 °K

то есть увеличивается почти в миллиард раз!
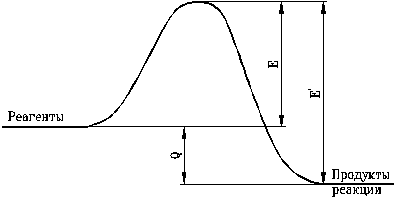
Связь между энергиями активации прямой и обратной реакций и тепловым эффектом очень проста. Для экзотермической реакции:
Дата добавления: 2015-03-03; просмотров: 697;
