Цепная неразветвленная реакция
Рассмотрим цепную неразветвленную реакцию на примере реакции водорода с хлором. В принципе эта реакция может идти через простые двойные столкновения
H2 + Cl2 = 2HCl,
однако цепной процесс оказывается более быстрым, так что приведенная реакция не оказывает сколько-нибудь существенного влияния на образование хлористого водорода.
Образование HCl происходит в результате последовательного чередования реакций с участием активных центров – атомарного хлора и атомарного водорода.
Первичными активными центрами являются атомы хлора, образующиеся при диссоциации молекул хлора при столкновениях типа:
Cl2 + M = CL + CL + M, (k1) (1)
где M – некоторая третья частица;
k1 – константа скорости данной реакции.
Данная реакция называется реакцией зарождения цепей.
Образованием атомарного водорода по реакции
H2 + M = H + H + M
можно пренебречь в силу гораздо большей прочности связи молекулы H2 (энергия связи 431 кДж/моль по сравнению с 238 кДж/моль для Cl2).
Возможна и обратная реакция – реакция обрыва цепей:
Cl + Cl + M = Cl2 + M, (k1') (2)
но в присутствии молекулярного водорода атомы хлора могут реагировать иным путем:
Cl + H2 = HCl + H. (k2) (3)
Энергия активации данной реакции E » 25 кДж/моль, а для реакции
H2 + Cl2 = 2HCl
E » 167 кДж/моль.
Несмотря на то, что атомов хлора много меньше, чем молекул хлора, благодаря малой энергии активации, реакция (3) идет гораздо быстрее.
При образовании конечного продукта, хлористого водорода, образовался новый активный центр, атом водорода H, который реагирует по реакции:
H + Cl2 = HCl + Cl (k3) (4)
с еще большей скоростью, чем атом хлора с молекулой водорода.
Таким образом, после образования двух молекул HCl атомарный хлор восстановился и далее реакции (3) и (4) повторяются многократно. Небольшое количество атомов хлора ведет реакцию, причем сами они практически не расходуются, их количество примерно постоянно.
Реакции (3) и (4) – это реакции продолжения цепей.
Найдем концентрации атомов водорода и хлора. Применим метод стационарных концентраций.
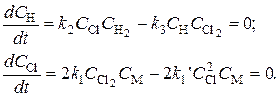
Отсюда
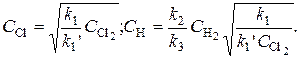
Полная скорость процесса образования HCl:
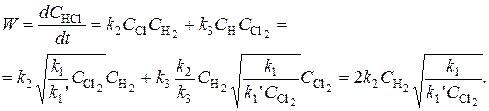
Дробный порядок реакции по хлору как раз и говорит о том, что реакция носит сложный, цепной характер.
Оценим численное значение W. Отношение 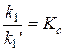 .
.
Для реакции Сl2 « 2Cl
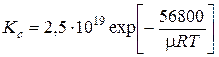 [м3]
[м3]
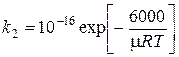 [м3/с]
[м3/с]
Подставив эти значения в выражение для W, получим
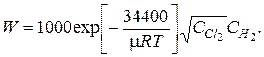
При T = 600°K и начальных концентрациях хлора и водорода 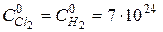 м-3 (давление p = 1 атм) это дает начальную максимальную скорость реакции W0 » 6,5×1024 1/(м3×с), что примерно в миллион раз больше, чем скорость простой бимолекулярной реакции:
м-3 (давление p = 1 атм) это дает начальную максимальную скорость реакции W0 » 6,5×1024 1/(м3×с), что примерно в миллион раз больше, чем скорость простой бимолекулярной реакции:
H2 + Cl2 = 2HCl.
Время реакции при этом давлении порядка 1 секунды.
Дата добавления: 2015-03-03; просмотров: 1427;
