Цепное самовоспламенение
Цепное самовоспламенение рассмотрим на примере реакции окисления водорода.
Цепные реакции идут через образование активных центров (атомов, радикалов). Их количество по ходу реакции может увеличиваться по двум причинам:
а) диссоциация молекул (скорость этого процесса мала);
б) разветвление цепи, то есть при химической реакции с участием одного атома образуется несколько аналогичных активных центров; в этом случае скорость образования активных частиц пропорциональна их концентрации.
Кроме процессов, порождающих активные частицы, всегда есть процессы, приводящие к их гибели. Если активная частица выводится из реакции при столкновении со стабильной молекулой или в результате диффузии к стенкам сосуда, то скорость процесса также пропорциональна концентрации активных частиц.
Скорость изменения концентрации активных частиц имеет вид:
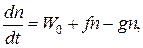
где W0 – скорость зарождения активных центров;
f и g – константы скоростей процессов разветвления и обрыва цепей.
Обозначим
f – g = j,
тогда
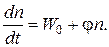
Изменение температуры и давления вызывает изменение обеих констант скоростей (f и g), но f, как правило, больше зависит от температуры. Дело в том, что обрыв цепи не требует энергии активации (такие реакции идут без разрыва связи), поэтому с ростом температуры j = f – g меняет знак: при низкой температуре j < 0, а при высокой j > 0.
При низких температурах 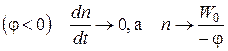 ,
,
оставаясь малой величиной.
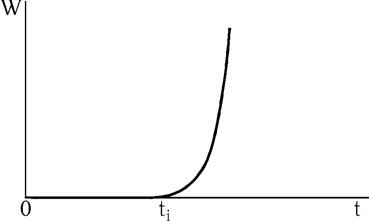
При j > 0 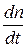 непрерывно возрастает. Температура, при которой j = 0, и является критической температурой, ниже которой взрыв невозможен.
непрерывно возрастает. Температура, при которой j = 0, и является критической температурой, ниже которой взрыв невозможен.
Скорость реакции, то есть скорость образования конечных продуктов, определяется по следующей зависимости:
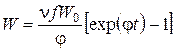 ,
,
где n– целое число порядка 1, указывающее, сколько образуется молекул конечного продукта в результате вступления в реакцию одного активного центра.
Если j > 0, то W экспоненциально растет со временем. Для взрывных реакций W0 очень мала, поэтому, пока происходит накопление активных центров, W оказывается ниже предела измерений. Это время, пока W меньше предела измерений, и есть время индукции ti.
Приближенно можно принять 
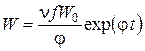 , так как при t > ti
, так как при t > ti 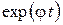 >> 0. Тогда
>> 0. Тогда
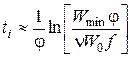 ,
,
где Wmin – минимальная измеряемая скорость реакции.
Если j= 0, то W = nfW0t, а 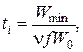 то есть и в этом случае скорость реакции растет, пока не начнет сказываться выгорание исходных веществ.
то есть и в этом случае скорость реакции растет, пока не начнет сказываться выгорание исходных веществ.
Если j< 0, то W стремится к пределу 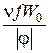 . Так как этот предел для взрывных реакций очень мал (меньше Wmin), то при j < 0 реакция практически не идет.
. Так как этот предел для взрывных реакций очень мал (меньше Wmin), то при j < 0 реакция практически не идет.
При очень малых отрицательных j достаточно лишь небольшого изменения внешних условий (температуры, давления), приводящих к ничтожному увеличению f, чтобы j переменила знак и реакция начала самоускоряться.
При окислении водорода суммарная реакция 2H2 + O2 = 2H2O содержит ряд элементарных реакций:
OH + H2 = H2O + H;
H + O2 = OH + O;
O + H2 = OH + H.
Фактически протекает следующая реакция:
H + 3H2 + O2 = 3H + 2H2O. (*)
Рассмотрим протекание этой реакции по стадиям на схеме, приведенной ниже.
 |  | ||
 H2 H2
|  H2 + OH = H2 + OH =
| H+H2O |
 H H
| Н + O2 = O + OH | |
| ||
 O2 O2
| ||
 H2 H2
|  Н2 + O = OH + Н2 + O = OH +
| H |
 H2 H2
| H2 + OH = | H + H2O |

| ||
| H+3H2+O2 | = | 3H+2H2O |
Таким образом, один атом водорода в результате этих реакций порождает три новых активных частицы. При протекании реакции (*) тепловой эффект незначителен, всего 5,5 ккал/моль воды. Поэтому в начальный период реакции, когда происходит накопление активных центров, тепла выделяется мало, а когда атомов водорода становится много, то они начинают рекомбинировать H + H = H2 с выделением большого количества тепла. Поэтому ускорение химической реакции идет именно за счет цепного ее характера, а не за счет диссоциации молекул H2 на атомы вследствие разогрева смеси.
Но в других реакциях возможен и другой механизм взрывных реакций, связанный с разогревом реагирующей смеси теплом, выделяющимся в результате химической реакции.
Дата добавления: 2015-03-03; просмотров: 1455;
