Воспламенение газовых взрывчатых систем
Газовые взрывчатые системы представляют собой преимущественно смеси горючих газов или паров с кислородом или воздухом. Воспламенение газовой смеси может быть достигнуто либо в результате подогрева смеси, либо вследствие местного ее зажжения (искрой и т.п.).
В первом случае химическая реакция протекает одновременно во всем объеме сосуда, в котором заключен газ; во втором – в месте зажжения возникает пламя, распространяющееся по исходному веществу. Пламя – это тонкая зона, отделяющая еще не реагировавшую исходную смесь от конечных продуктов реакции, в которых химическая энергия перешла в тепловую. Распространение пламени может протекать в детонационной форме или в форме нормального горения.
Воспламенение и последующее горение газовой смеси может происходить лишь в том случае, если химическая реакция протекает в условиях прогрессивного самоускорения. Критические условия воспламенения поэтому определяются условиями перехода от стационарного к нестационарному протеканию реакции.
Если при некоторых значениях внешних параметров (давления и температуры) концентрации активных промежуточных продуктов реакции начинают возрастать существенно нестационарным образом, то это явление называется цепным или диффузионным воспламенением. Цепное горение возможно только в случае автокаталитических реакций (разветвляющихся цепных реакций). Цепной механизм воспламенения встречается, главным образом, при сравнительно низких давлениях (значительно ниже атмосферного).
Газовая смесь способна самовоспламениться не при любых значениях внешних параметров. Кривая самовоспламенения выглядит чаще всего следующим образом.
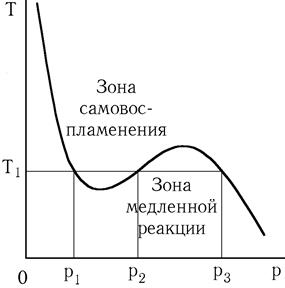
Как мы видим, существует диапазон температур смеси, в котором существуют три предела воспламенения. Чем это объяснить? Рассмотрим, как будет протекать реакция при температуре T1. При очень низких давлениях (p < p1) воспламенения смеси происходить не будет вследствие интенсивной гибели активных центров на стенке сосуда (обрыв цепей). При давлениях p1 < p < p2 реакции разветвления цепей преобладают над реакциями их обрыва, и происходит лавинообразное ускорение химической реакции, самовоспламенение и взрыв. При давлении p2 < p < p3 реакция опять будет протекать медленно, так как вследствие более высокого давления, интенсивно происходит обрыв цепей в самой газовой смеси. И, наконец, при давлении p > p3 снова будет наблюдаться самоускорение реакции, воспламенение и взрыв, но воспламенение будет иметь тепловой механизм.
В чем он состоит? При низких давлениях выделение тепла в ходе химической реакции компенсируется теплоотводом в окружающую среду через стенки сосуда. При увеличении давления выделение тепла в сосуде увеличивается, что ведет к повышению температуры смеси. При этом увеличивается теплоотдача через стенки сосуда, но увеличивается и скорость химической реакции, а значит и выделение тепла.
Так как скорость реакции (тепловыделения) растет с температурой по экспоненциальному закону (закон Аррениуса), а скорость теплоотвода увеличивается с ростом температуры примерно по линейному закону, то тепловое равновесие нарушается и наблюдается непрерывное самоускорение реакции, приводящее к взрыву.
Таким образом, изображенная нами кривая Tвоспл = f(p), будет зависеть не только от химического состава газовой смеси, но и от размеров и формы сосуда, материала и качества обработки поверхности.
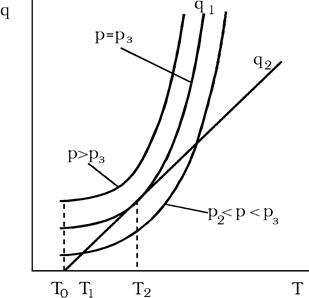
Здесь q1 – теплоприход;
q2 – теплоотвод через стенки;
T0 – начальная температура газовой смеси;
T1 – температура, которая установится для медленной реакции;
T2 – температура неустойчивого равновесия теплоприхода и теплоотвода.
Незначительное увеличение температуры смеси сверх T2 повлечет за собой взрыв.
Как показывают практические расчеты, температуры T0, T1 и T2 очень близки (диапазон T0 – T2 составляет лишь несколько градусов).
Горение газовой смеси возможно не при любом процентном ее составе. При изменении состава смеси могут быть достигнуты некоторые границы, вне которых даже самая мощная искра не способна вызвать распространение пламени. Эти границы называются концентрационными пределами. Нижний предел обусловлен недостатком горючего, а верхний – недостатком кислорода.
Концентрационные пределы зависят не только от состава смеси, но и от условий опыта. С повышением мощности инициирующего импульса, начальной температуры и давления газовой смеси концентрационные пределы расширяются. Например, зависимость концентрационных пределов от давления выглядит так, как показано на рисунке.
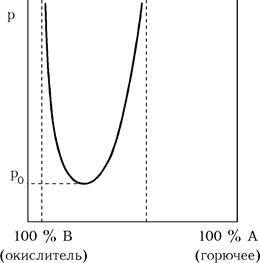
При давлениях ниже p0 взрыв вообще не возможен.
Концентрационные пределы зависят также от того, где происходит поджигание газа. При зажигании снизу, то есть при распространении пламени вверх, концентрационные пределы всегда шире, чем при распространении пламени вниз. Дело в том, что пламя не может двигаться вниз, когда его скорость ниже скорости конвективного движения горячих продуктов горения.
Концентрационные пределы зависят также и от диаметра трубки. Одна и та же смесь горит в широких трубках и не горит в узких, диаметры которых меньше критического. Этот эффект использовался в конструкции безопасной шахтерской лампы, в которой медная сетка с мелкими отверстиями исключала распространение пламени из лампы в атмосферу шахты. На завалочных машинах, обслуживающих мартеновские печи, рабочие также защищены от пламени сеткой с мелкими ячейками.
Причина возникновения концентрационных пределов состоит в теплопотерях в окружающее пространство (теплоотвод через стенки трубки и теплооотвод излучением). При распространении пламени в узких трубках предел связан с теплоотдачей в стенки. Концентрационные пределы, вне которых распространение пламени невозможно ни при каких диаметрах сосуда, обусловлены теплоотдачей излучением.
Дата добавления: 2015-03-03; просмотров: 990;
