Агрегатные состояния вещества. Фазовые переходы
Все знают, что вещество может находиться в трех основных агрегатных состояниях: газообразном, жидком и твердом. Например, вода может существовать в виде льда, жидкой воды и пара. Чем отличаются эти состояния? Самые очевидные различия заключаются в следующем: твердое состояние сохраняет объем и форму, жидкое – только объем и принимает форму сосуда, газообразное – не сохраняет ни объем, ни форму. Однако встает вопрос: чем отличаются эти состояния с точки зрения молекулярно-кинетической теории? Во всех трех агрегатных состояниях атомы и молекулы одинаковы. Следовательно, различие заключается в их взаимодействии друг с другом.
В газообразной фазе молекулы находятся на большом расстоянии друг от друга, поэтому они взаимодействуют слабо. Взаимодействие молекул происходят только в момент их столкновений. В этом состоянии молекулы могут разлетаться в разные стороны, занимая весь объем сосуда, в который помещена система. Взаимодействие между молекулами характеризуется потенциальной энергией U, которая является отрицательной при не слишком плотном сближении (рис. 3.2). С другой стороны, молекулы обладают кинетической энергией, которая связана с температурой 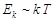 . Для газообразного состояния системы выполняется условие
. Для газообразного состояния системы выполняется условие 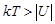 , т. е. кинетическая энергия молекул больше потенциальной энергии. При этом молекулы не могут находиться в связанном состоянии.
, т. е. кинетическая энергия молекул больше потенциальной энергии. При этом молекулы не могут находиться в связанном состоянии.
В жидкости молекулы находятся на близком расстоянии друг от друга и сильно взаимодействуют. Их потенциальная энергия превышает по величине кинетическую 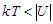 , поэтому молекулы не могут оторваться друг от друга и разлететься по всему объему сосуда. Благодаря этому жидкости сохраняют свой объем при переливании из одного сосуда в другой. В то же время молекулы могут перемещаться среди других молекул жидкости, находясь при этом все время в связанном состоянии. Этим обусловлены текучесть жидкостей и несохранение ими формы.
, поэтому молекулы не могут оторваться друг от друга и разлететься по всему объему сосуда. Благодаря этому жидкости сохраняют свой объем при переливании из одного сосуда в другой. В то же время молекулы могут перемещаться среди других молекул жидкости, находясь при этом все время в связанном состоянии. Этим обусловлены текучесть жидкостей и несохранение ими формы.
В твердом состоянии молекулы сильно взаимодействуют друг с другом ( 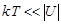 ), так что они совершают колебательные движения около своих положений равновесия. Благодаря этому твердые тела сохраняют свои объем и форму.
), так что они совершают колебательные движения около своих положений равновесия. Благодаря этому твердые тела сохраняют свои объем и форму.
Между этими тремя состояниями вещества не существует непреодолимой границы. Мы видим, что, изменяя температуру, можно получить любое из этих состояний. Переход вещества из одного агрегатного состояния в другое называется фазовым переходом, а сами эти состояния – фазами. Например, нагревая лед до 0 °С, можно расплавить его и превратить в воду. Нагревая затем воду до 100 °С, можно испарить ее. Мы видим, что фазовые переходы происходят при определенных условиях (температуре и давлении), при которых могут существовать одновременно две фазы вещества. Большинство веществ в природе может существовать во всех трех состояниях. Однако мы обнаруживаем, что кислород и азот существуют на Земле в газообразной фазе, а большинство металлов – в твердом состоянии. Это связано с тем, что температуры кипения кислорода (–183 °С) и азота (–196 °С) слишком низки и могут быть реализованы только в искусственных условиях, а температуры плавления металлов слишком высоки (железо – 1535 °С, золото – 1063 °С, алюминий – 660 °С) и достигаются в специальных плавильных печах.
Условия, при которых вещество существует в различных фазах, можно наглядно представить при помощи фазовых диаграмм. На рис. 3.3 представлена примерная фазовая диаграмма однокомпонентной системы. Линии на этом рисунке представляют кривые сосуществования (в координатах 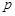 и
и 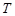 ) двух фаз: твердое тело–газ, твердое тело–жидкость, жидкость–газ. Существует одна точка Т на фазовой диаграмме, в которой возможно существование одновременно
) двух фаз: твердое тело–газ, твердое тело–жидкость, жидкость–газ. Существует одна точка Т на фазовой диаграмме, в которой возможно существование одновременно
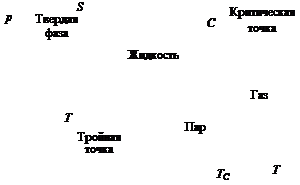
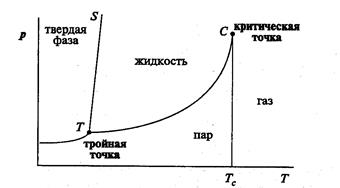
Рис. 3.3. Фазовая диаграмма однокомпонентной системы
трех фаз. Эта точка называется тройной точкой системы. Для воды тройной точке соответствуют следующие параметры: 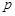 = 600 Па,
= 600 Па, 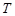 = 273,16 K. Кроме тройной точки на фазовой диаграмме присутствует так называемая критическая точка С. Температура, соответствующая этой точке,
= 273,16 K. Кроме тройной точки на фазовой диаграмме присутствует так называемая критическая точка С. Температура, соответствующая этой точке, 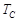 называется критической. Если система имеет температуру выше
называется критической. Если система имеет температуру выше 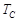 , то она находится в газовой фазе и ее нельзя перевести в жидкость путем повышения давления. Критическая точка для воды:
, то она находится в газовой фазе и ее нельзя перевести в жидкость путем повышения давления. Критическая точка для воды: 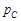 = 218·105 Па,
= 218·105 Па, 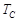 = 647,3 K.
= 647,3 K.
Дата добавления: 2015-01-15; просмотров: 3859;
