Уровни описания молекулярных систем
Вещество, состоящее из большого количества молекул или атомов, будем называть молекулярной системой или просто системой. Таким образом, системами являются газы и жидкости, помещенные в некоторый объем, а также твердые тела. Существует три уровня описания молекулярных систем: механический, термодинамический и статистический.
Механический уровень описания заключается в том, что задаются координаты и скорости всех молекул системы в любой момент времени. Это очень подробный уровень описания, который невозможно осуществить практически. Дело в том, что сравнительно малый объем вещества содержит огромное количество молекул. Например, 18 г воды содержит 6·1023 молекул. Такое количество не может рассчитать ни одна современная ЭВМ. Тем не менее этот уровень описания важен для теоретических выводов при переходе к другим уровням описания.
Термодинамический уровень заключается в том, что задаются термодинамические параметры системы, характеризующие систему в целом. Термодинамическими параметрами могут служить объем, занимаемый системой, температура, давление, внутренняя энергия, энтропия и т. д. Если газ или жидкость поместить в некоторый сосуд объемом 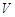 , то они действуют на стенки сосуда с силой
, то они действуют на стенки сосуда с силой 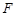 перпендикулярной поверхности. Отношение этой силы к площади поверхности стенок сосуда называется давлением
перпендикулярной поверхности. Отношение этой силы к площади поверхности стенок сосуда называется давлением 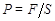 . Единицей измерения давления является паскаль
. Единицей измерения давления является паскаль 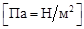 . Часто давление измеряется в атмосферах (1 атм = 1,01325·105 Па) или в миллиметрах ртутного столба (760 мм рт. ст. = 1 атм). Важным термодинамическим параметром системы является температура. Температура измеряется в градусах Цельсия (°С) или в кельвинах (K). Нуль градусов Цельсия соответствует 273,15 K (0 °С = 273,15 K). Условия, при которых t = 0 °C и P =
. Часто давление измеряется в атмосферах (1 атм = 1,01325·105 Па) или в миллиметрах ртутного столба (760 мм рт. ст. = 1 атм). Важным термодинамическим параметром системы является температура. Температура измеряется в градусах Цельсия (°С) или в кельвинах (K). Нуль градусов Цельсия соответствует 273,15 K (0 °С = 273,15 K). Условия, при которых t = 0 °C и P =
= 1 атм, называются нормальными условиями.
Объем, давление и температура системы не являются независимыми величинами. Связь между ними называется уравнением состояния системы: 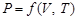 . Для идеального газа уравнение состояния называется уравнением Клапейрона – Менделеева:
. Для идеального газа уравнение состояния называется уравнением Клапейрона – Менделеева: 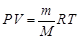 . Здесь m – масса газа, M – молярная масса газа (масса одного моля), R =
. Здесь m – масса газа, M – молярная масса газа (масса одного моля), R =
= 8,31 Дж/(моль·K) – универсальная газовая постоянная. Это уравнение показывает, что давление газа возрастает с увеличением его температуры и уменьшением его объема. Уравнение Клапейрона – Менделеева – это один из примеров термодинамического описания сис-темы.
Третий уровень описания системы – статистический – занимает промежуточное положение между механическим и термодинамическим. Этот уровень характеризуется тем, что задаются не точные координаты и скорости всех молекул, а лишь вероятность для произвольной молекулы иметь некоторую скорость и находиться в определенном месте пространства. Введение вероятностей позволяет пользоваться математическим аппаратом теории вероятностей. Используя введенные вероятности, можно определить термодинамические параметры системы как средние величины от некоторых динамических переменных молекул, т. е. от функций скоростей и координат молекул. Так, было показано, что температура, по существу, является средней кинетической энергией одной молекулы системы. Эта связь выражается формулой
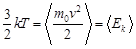 .
.
Здесь 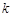 = 1,38 · 10–23 Дж/K – постоянная Больцмана, m0 – масса одной молекулы системы, v – скорость молекулы. Угловые скобки означают, что кинетическую энергию надо усреднить по всем молекулам системы. Это соотношение показывает, что температура системы определяется средней скоростью хаотического движения молекул: чем быстрее двигаются молекулы, тем выше температура системы.
= 1,38 · 10–23 Дж/K – постоянная Больцмана, m0 – масса одной молекулы системы, v – скорость молекулы. Угловые скобки означают, что кинетическую энергию надо усреднить по всем молекулам системы. Это соотношение показывает, что температура системы определяется средней скоростью хаотического движения молекул: чем быстрее двигаются молекулы, тем выше температура системы.
Все три уровня описания молекулярных систем связаны между собой. Используя механический уровень описания, можно вывести уравнения для расчета вероятностей динамических величин молекул системы, а, решая их, можно рассчитать термодинамические параметры системы в целом. В то же время статистический уровень описания предполагает случайные изменения параметров системы в отличие от механического, при котором поведение системы строго детерминировано. Это различие напоминает различие атомарных концепций Демокрита и Эпикура.
Дата добавления: 2015-01-15; просмотров: 1994;
