Оксиды на поверхности металлов, механизм их образования и роста. Сравнительная характеристика физической и химической стойкости оксидов.
В атмосферных условиях металлы покрыты оксидными пленками. Первично образующаяся на металле оксидная пленка может иметь аморфную или кристаллическую структуру. Например, в случае окисления алюминия при комнатной температуре образуется аморф-ная пленка толщиной 20¸45Å, которая при нагреве становится кри-сталлической. Первичная пленка на железе меди, цинке с самого на-чала имеет кристаллическое строение. Образование аморфных или кристаллических первичных оксидных пленок зависит не только от физико-химической природы окисляемого металла, но и от условий ее образования, в основном от температуры.
При комнатной температуре в атмосфере воздуха вначале окисление металла идет быстро, но при достижении определенной толщины пленки процесс окисления практически заканчивается. Так, при окислении меди приблизительно через 2 часа толщина пленки достигает 24Å, а затем почти не изменяется. После образования первичной пленки дальнейшее окисление определяется скоростью диффузии через нее металла и кислорода. При диффузии металла зоной роста является внешняя поверхность оксидной пленки. При диффузии кислорода зоной роста является граница металл-оксидная пленка. При соизмеримых скоростях встречной диффузии металла и кислорода зона роста находится внутри оксидной пленки. Схема роста оксидной пленки в этом случае представлена на рис. 1
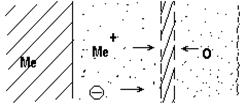 |
Рис. 1 – Схема роста оксидной пленки при соизмеримых скоростях встречной диффузии металла и кислорода
Так как оксидные пленки на металлах имеют кристаллическую структуру, обладающую ионной, а также электронной проводимостью, то при диффузии через пленку перемещаются не непосредственные атомы металла, а ионы и свободные электроны. Это не исключает возможности атомной диффузии, но поскольку радиусы ионов металлов значительно меньше атомов, то можно предположить, что основной диффузионный поток от металла будет состоять из их ионов. Кислород же проникает внутрь оксидной пленки в виде атомов, а не ионов, т.к. размер атомов кислорода в два с лишним раза меньше радиуса иона кислорода.
В процессе образования оксидных пленок закон их роста может быть различным, что в основном определяется соотношением объема оксида Vокк объему металла Vм, из которого он образовался. Например, это отношение для некоторых металлов имеет следующее значение:
Mg – 0,35 Zn – 1,57 Ni – 1,64
Sn – 1,31 Cu – 1,71 W – 3,50
Al – 1,38 Fe – 1,78
Если отношение объема оксида к объему металла меньше единицы Vок /Vме< 1, то образуются не сплошные, пористые оксидные пленки, обладающие слабыми защитными свойствами. Для таких металлов скорость роста оксидной пленки определяется линейным законом
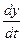 = k, (1)
= k, (1)
где y – толщина оксидной пленки;
t– время окисления;
k – константа.
После интегрирования зависимости (4.1) получим
y = kt + A(2)
Линейный характер роста пленки устанавливается через некоторое время после начала окисления, когда пленка достигает критической величины. Это наблюдается на щелочных и щелочноземельных металлах, а также на таких металлах как ванадий, молибден, вольфрам, образующих оксиды, легко испаряющиеся при нагреве.
Металлы, для которых Vок/Vме< 1, при окислении образуют сплошной слой оксидной пленки. Для них характерен рост пленки по параболическому закону
y2 = kt + A(3)
Для некоторых металлов рост пленки можно описать зависимостью
yn = kt + A (4)
(Частный случай – кубическая парабола при n = 3)
Иногда наблюдается логарифмическая зависимость роста оксидной пленки.
y = ln(kt)(5)
Скорость роста оксидной пленки в процессе окисления зависит от температуры. С повышением температуры скорость увеличивается в соответствии с зависимостью
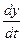 = Ае–Q/RT,(6)
= Ае–Q/RT,(6)
где Q – энергия активации процесса;
R – газовая постоянная;
T – абсолютная температура.
Следует отметить, что рассмотренные закономерности роста оксидной пленки соблюдается лишь для чистых металлов. Наличие даже следов примесей может сильно изменить свойства поверхности металла и характер реакций его с кислородом.
Образующиеся на металлах в результате окисления пленки делятся на тонкие, средние и толстые. Тонкими принято считать невидимые пленки от мономолекулярных до 400Å, средними от 400 до 5000Å и толстыми – выше 5000Å (0,5 мкм). В процессе пайки металлов большое значение имеют не только толщины, но и свойства оксидных пленок. Плотные, прочно связанные с металлом оксидные пленки труднее удалить с поверхности металла, что осложняет процесс пайки. Чем менее компактна оксидная пленка, чем слабее ее связь с металлом и, чем менее устойчива она при нагреве, тем меньше затруднений возникает в процессе удаления ее при пайке.
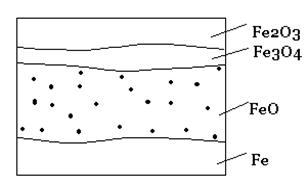
При окислении железа кислородом возможно образование разных соединений в соответствии с диаграммой состояния железо-кислород. Оксидная пленка на железе обычно имеет четко выраженный слоистый характер. На границе с металлом образуется монооксид железа FeO, соответствующая наименьшему содержанию кислорода в оксиде, затем следует промежуточный слой монооксида-оксида железа Fe3O4 и на внешней поверхности пленки – высший оксид Fe2O3. Предполагается, что поверхностный слой металла, находящийся под оксидной пленкой, содержит некоторое количество кислорода в виде твердого раствора с металлом.
Прилегающий к металлу слой монооксида железа FeO (вюстит) имеет кубическую кристаллическую решетку по типу каменной соли. FeO устойчив только при температурах выше 570 0С. При более низких температурах он не образуется, а при медленном охлаждении распадается с выделением металла по реакции:
4FeO Þ Fe + Fe3O4
При температуре 1377 0С монооксид железа плавится.
Монооксид-оксид железа Fe3O4 (магнетит) имеет кристалличесую кубическую решетку. Магнетит кристаллографически является самостоятельной фазой, а не молекулярной смесью монооксида и оксида железа. Он устойчив при всех температурах, начиная от комнатной и до точки плавления железа. При нагреве в окислительной среде магнетит переходит в оксид железа a-Fe2O3. Этот переход совершается в две стадии. При нагреве до температуры 220 0С образуется промежуточная структура оксида g- Fe2O3 с сохранением кубической шпинельной решетки. Двухвалентное железо при этом превращается в трехвалентное:
2 Fe3O4 + ½O2 Þ 3 Fe2O3
 |
При дальнейшем нагреве до 400-500 0С оксид теряет магнитные свойства и образуется решетка оксида железа a- Fe2O3.
Рис. 2 – Микроструктура оксидной пленки на железе (схема)
Оксид железа Fe2O3 (гематит) имеет ромбоэдрическую структуру. Гематит устойчив в широком интервале температур, но при нагреве выше 1100 0С частично разлагается. При температуре плавления железа гематит полностью диссоциирует на железо и кислород.
При окислении меди образуются три вида оксидов – монооксид меди Cu2O, оксид меди CuO и полуторный оксид меди Cu2O3. Имеются также предположения об образовании в интервале 950-1050 0С соединения типа недооксида Cu4O. Окисление меди начинается с адсорбции газа на ее поверхности. При комнатной температуре на воздухе происходит образование оксида меди, кристаллизующегося в кубической решетке. Кристаллическая решетка оксида меди ориентирована так, что ребра и грани кубической решетки Cu2O лежат параллельно и граням кубической решетки меди.
Нагрев меди выше 250 0С вызывает более интенсивное окисление, при этом пленка состоит из смеси оксида и монооксида меди. Рост пленки происходит по диффузионному механизму; предполагают, что при повышенных температурах через пленку диффундируют ионы меди, имеющие малый размер. При 300 0С и выдержке 5÷10 мин в атмосфере воздуха медь покрывается цветами побежалости.
Наряду с монооксидом меди при окислении также образуется полуторный оксид меди, который, как и монооксид, имеет красный цвет. Кристаллическая решетка его соответствует решетке монооксида меди и отличается от последней только удельной проводимостью. Полуторный оксид меди неустойчив, он начинает разлагаться при 750С. При 400 0С разложение происходит по уравнению
Cu2O3 Þ 2 CuO + ½O2
В интервале 400 – 500 0С и выдержке 5¸15 мин окисная пленка на меди двухслойная. К металлу примыкает монооксид меди, верхний более тонкий слой состоит из оксида меди, имеющий почти черный цвет. Оксидная пленка в интервале 600 – 800 0С имеет мелкокристаллическую структуру и плохую связь с металлом. Выше 800 0С образовавшийся оксид меди разлагается по уравнению
4 CuO Þ 2 Cu2O + O2
В интервале 800 – 950 0С пленка состоит только из монооксида меди. Этот интервал характерен несколько более прочной связью пленки с основным металлом. При 950¸1050 0С оксидная пленка приобретает ярко малиновый цвет, что связано, по-видимому, с образованием соединения Cu4O. Оксидная пленка в этом интервале имеет крупнокристаллическую структуру и наиболее прочно держится на металле.
Алюминий при взаимодействии с кислородом при комнатной температуре окисляется с образованием первичной оксидной пленки толщиной 40¸100 мкм. Дальнейшее окисление алюминия тормозится, т.к. образовавшаяся пленка надежно изолирует металл от кислорода. Для оксида алюминия известны модификации a, b, g и др. Наряду с оксидом алюминия известны оксиды состава Al2O – недооксид алю-миния и AlO – субоксид алюминия, существующие при высоких температурах. Первоначально образующийся на поверхности алюми-ния оксидный слой в атмосферных условиях представляет собой аморфное образование. Умеренное нагревание этого слоя до темпе-ратуры выше 200 0С приводит к возникновению модификации g- Al2O3. В результате взаимодействия с влагой воздуха в оксидной пленке на поверхности алюминия могут образовываться гидрооксиды.
Применяемые в качестве припоев металлы и сплавы также имеют на своей поверхности оксидную пленку. Нагрев под пайку при недостаточной защите может вызывать дальнейшее окисление припоя. Наличие на поверхности припоя в процессе пайки оксидной пленки приводит к ухудшению условий пайки и свойств паяных соединений. Поэтому для получения качественных паяных соединений необходима очистка припоя перед пайкой и надежные условия удаления оксидов в процессе пайки.
В зависимости от состава припои имеют различную окисляемость. Наибольшей стойкостью при высоких температурах отличаются припои на основе никеля.
При легировании основы паяемого металла или припоя легирующие элементы по-разному могут влиять на образование оксидной пленки. Скорость окисления металла может или уменьшаться или увеличиваться. Если легирующие элементы обладают меньшим сродством к кислороду по сравнению с основным металлом, то они обычно остаются под оксидной пленкой в неокисленном состоянии.
На основе анализа состава и строения оксидных пленок можно видеть, что даже при самых благоприятных условиях окисления чистых металлов и сплавов в атмосфере воздуха образующиеся пленки имеют толщину более 20Å. Силы взаимодействия атомов металлов между собой практически исчезают на расстояниях более 10 ангстрем, поэтому обеспечить взаимодействие паяемого металла и расплавленного припоя при наличии на их поверхности оксидных пленок невозможно. Следовательно, металлы необходимо тщательно очищать от оксидных пленок и загрязнений, для чего перед пайкой надо производить механическую зачистку или травление их поверхности в растворах щелочей или кислот. Однако за время между очисткой и пайкой на поверхности металлов вновь образуется тонкая оксидная пленка. Поэтому непосредственно в процессе пайки необходимо удалять оксидную пленку не только с паяемого металла, но и с расплавленного припоя, что достигается применением при пайке флюсов, искусственных газовых сред, вакуума, а также физико-механическими способами разрушения оксидной пленки.
ЛЕКЦИЯ №5
Дата добавления: 2015-02-28; просмотров: 6567;
