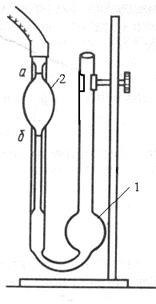
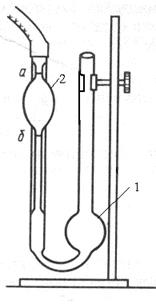
Експериментальна частина. 1. У капілярний віскозиметр (рис
віскозиметр |
1. У капілярний віскозиметр (рис. 17) залити 10 мл розчинника (дистильована вода) через широке коліно в кулю 1.
2. За допомогою груші через капіляр затягнути розчинник вище мітки над кулею 2 на 1-2 см.
3. Зняти грушу. Як тільки меніск рідини зрівняється з верхньою міткою над кулею 2, пустити секундомір та визначити час витікання розчинника з кулі між двома мітками.
4. Операції 2-3 повторити 3 рази. Записати середнє значення часу витікання.
5. Замінити розчинник розчином ВМС та виміряти час його витікання згідно з пп. 3-4. По черзі провести вимірювання для розчинів заданих концентрацій.
3. Обробка результатів
1. Записати одержані дані в табл. 16:
Таблиця 16
| С, % | t, с | hвідн | hпит | hзвед |
2. За даними таблиці побудувати графік hзвед= f(C) та згідно з рис. 16 провести визначення характеристичної в’язкості [h]. Якщо отримана залежність має яскраво виражений нелінійний характер, то операцію екстраполяції провести в координатах ln(hвідн)/C =f(C).
3. Обчислити молярну масу ВМС, використавши відповідні для даного полімеру значення констант K та a (табл. 17).
Таблиця 17
| Полімер | Розчинник | t, 0C | K.104 | a | Діапазон M.10-3, в якому визначені константи |
| Поліакриламід | Вода | 0,631 | 0,8 | 10-5000 | |
| Полівиниловий спирт | Вода | 3,0 | 0,5 | 8,5-1700 | |
| Поліетиленоксид | Вода | 1,66 | 0,82 | 0,4-4,0 | |
| Ацетат целюлози | Ацетон | 0,19 | 1,03 | 11-130 |
Контрольні запитання та завдання
1. Окрім осмометричного та віскозиметричного методів існують інші методи визначення молярної маси ВМС. Назвіть їх. У чому полягає сутність цих методів?
2. У чому полягає різниця понять «середньочислова» та «середньомасова» молярна маса ВМС?
3. Поясніть, чи можна на підставі віскозиметричних досліджень одержати інформацію щодо форми макромолекули.
4. Обгрунтувати, чому білкова глобула має сферичну форму тільки в ізоелектричній точці.
5. Обчислити молярну масу полістиролу в толуолі за даними віскозиметричних вимірювань (табл. 18).
Таблиця 18
| Концентрація розчину, С (кг/м3) | 1,70 | 2,12 | 2,52 | 2,95 | 3,40 | К | a | ||
| Час витікання розчину t, с | 97,6 | 115,1 | 120,2 | 124,5 | 129,8 | 134,9 | 1,7 10-5 | 0,69 |
6. Обчислити молярну масу полівінілового спирту за даними віскозиметричного методу, якщо: [h] = 0,15, K = 4,53.10-5,a = 0,74.
7. Обчислити молярну масу поліметилметакрилату за даними віскозиметрії (табл. 19).
Таблиця 19
| Концентрація розчину | 1,0 | 1,2 | 1,4 | 1,6 | 1,8 | 2,0 |
| Зведена в’язкість | 0,408 | 0,416 | 0,430 | 0,434 | 0,442 | 0,452 |
Тут К = 4,7.10-5, a = 0,77.
8. Використовуючи константи віскозиметричного рівняння К = 5,11.10-5, a=0,72 за даними зведеної в’язкості нейлона у мурашиній кислоті (табл. 20), обчисліть молярну масу нейлона.
Таблиця 20
| Концетрація нейлону, С, кг/м3 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
| Зведена в’язкість | 0,09 | 0,096 | 0,104 | 0,109 | 0,117 |
9. Обчисліть молярну масу: а) полістіролу у толуолі за даними
[h] = 0,105, K = 1,7.10-5, a = 0,69;
б) натурального каучуку в бензині:
[h] = 0,126, K = 5.10-5, a = 0,67;
в) нітроцелюлози в ацетоні:
[h] = 0,204, K = 0,89.10-5, a = 0,9;
10. Обчисліть молярну масу перхлорвінілової смоли в циклогексані за віскозиметричними даними (табл. 21).
Таблиця 21
| Концентрація розчину, С, кг/м3 | 2,0 | 4,0 | 6,0 | 8,0 | 10,0 |
| Питома в’язкість розчину | 0,204 | 0,433 | 0,678 | 0,960 | 1,240 |
Тут К = 6,3.10-5, a = 0,67.
Список використаної літератури
1. Агафонова Е.И., Карпенко П.Г., Рябина. Л.В. Практикум по физической и коллоидной химии. - М.: Высш. шк., 1985. – 167 с.
2. Балезин С.А., Ерофеев В.В., Подобаев Н.И. Основы физической и коллоидной химии. – М.: Просвещение, 1975. – 398 с.
3. Воюцкий С.С. Курс коллоидной химии. – М.: Химия, 1975. – 512 с.
4. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. - М.: Высш. шк., 1990. – 487 с.
5. Захарченко В.А. Коллоидная химия. - М: Высш. шк., 1989. – 238 с.
6. Коллодная химия / И.А. Усков, Еременко Б.В., С.С. Пелишенко и др. – К.: Вища шк., 1988. – 167 с.
7. Лабораторные работы и задачи по коллоидной химии / Под ред. Ю.Г. Фролова и А.С. Гродского. – М.: Химия, 1986. – 218 с.
8. Фридрихсберг Д.А. Курс коллоидной химии. - Л.: Химия, 1984. – 368 с.
9. Колоїдна хімія / М.О. Мчедлов-Петросян, В.І. Лебідь, О.М. Глазкова та ін.. – Х.: Фолио, 2005. – 304с.
Зміст
Вступ
Програми колоквіумів
Розділ 1. Дисперсійний аналіз суспензій
Лабораторна робота 1. Седиментаційний аналіз полідисперсних систем
Розділ 2. Поверхневий натяг та адсорбція.
Лабораторна робота 2. Визначення поверхневого натягу на межі розподілу фаз рідина - пара. Перевірка правила Дюкло-Траубе.
Лабораторна робота 3. Визначення питомої поверхні адсорбенту.
Розділ 3. Стійкість та коагуляція дисперсних систем.
Лабораторна робота 4. Коагуляція гідрофобного золю.
Лабораторна робота 5. Одержання ліофобних золів.
Розділ 4. Міцелоутворення у водних розчинах поверхнево-активних речовин (ПАР).
Лабораторна робота 6. Визначення критичної концентрації міцелоутворення
Розділ 5. Властивості високомолекулярних речовин (ВМР) та їх розчинів.
Лабораторна робота 7. Вивчення кінетики набухання.
Лабораторна робота 8. Визначення мольної маси ВМС по в’язкості розчинів.
Додатки
Темплан 2001 р., поз.
ЛАБОРАТОРНИЙ ПРАКТИКУМ
З ФІЗИЧНОЇ ТА КОЛОЇДНОЇ ХІМІЇ
ДЛЯ НЕХІМІЧНИХ СПЕЦІАЛЬНОСТЕЙ
ЧАСТИНА ІІ. КОЛОЇДНА ХІМІЯ
Укладачі: канд.хім.наук, доц. Коваленко В.С., канд.хім.наук, доц. Коробов В.І.,
ас. Плясовська К.А., канд.хім.наук, доц. Тарасова Л.П., докт. хім.наук,
доц. Ткач В.І., канд.хім.наук, доц. Штеменко Л.В.
Редактор
Техредактор
Коректор
(Вихідні дані)
Дата добавления: 2015-02-16; просмотров: 940;