Експериментальна частина. 1. Одержати в лаборанта необхідні реактиви (наважки активованого вугілля, розчини оцтової кислоти різної концентрації).
1. Одержати в лаборанта необхідні реактиви (наважки активованого вугілля, розчини оцтової кислоти різної концентрації).
2. У 5 пронумерованих конічних колб внести по 1 г активованого вугілля. У кожну колбу влити по 15 мл розчину оцтової кислоти потрібної концентрації. Колби закрити пробками та залишити для адсорбції на 50 - 60 хв. Час від часу колби обережно струшувати так, щоб вугілля не залишалося на стінках.
3. За той час, поки йде адсорбція, відтитрувати розчини оцтової кислоти лугом (С = 0,1 н.) з індикатором (фенолфталеіном) до ледь рожевого кольору та розрахувати за отриманими даними їх концентрації (Со, моль/л).
4. Після адсорбції відфільтрувати вугілля через фільтр у пронумеровані колби-приймачі.
5. Одержані фільтрати відтитрувати (див. п.3) та розрахувати концентрації розчинів після адсорбції (С, моль/л).
6. Одержані в пп. 3 та 5 дані записати до табл. 6.
Таблиця 6
| № п/п | С0, моль/л | С, моль/л | (Со - С), моль/л | Г, моль/г | С/Г, г/л |
3.Обробка результатів
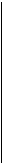 С/Г С/Г
  Г¥ Г¥ 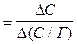  D(С/Г)
D(С/Г)
Рис. 10. Лінеарізована ізотерма Ленгмюра |
1. Розрахувати величину адсорбції Г за рівнянням
Г = (Со - С)V/m, (3.2)
де V -об’єм розчину, m - маса адсорбента в грамах.
2. За одержаними даними побудувати ізотерму адсорбції Г=f(С) (вважати, що ізотерма описується рівнянням Ленгмюра).  Лінеаризувати одержану ізотерму згідно з графіком, наведеним на рис. 10. Ізотерма адсорбції Ленгмюра являє собою пряму лінію в координатах С/Г від С. За одержаним графіком визначити величину граничної адсорбції Г¥.
Лінеаризувати одержану ізотерму згідно з графіком, наведеним на рис. 10. Ізотерма адсорбції Ленгмюра являє собою пряму лінію в координатах С/Г від С. За одержаним графіком визначити величину граничної адсорбції Г¥.
3. Обчислити питому поверхню адсорбента за рівнянням
Sm = Гоо NА Sо , (3.3)
де NА - число Авогадро; Sо -площа, яку займає молекула оцтової кислоти (взяти як таку, що дорівнює 20,5 Å2). Результат подати в см2/г.
4. Контрольні запитання та завдання
1. Що називається адсорбцією? Які бувають типи адсорбції за природою адсорбційних сил?
2. Наведіть та поясніть 5 типів ізотерм адсорбції з розчинів.
3. Які теорії адсорбції можуть описати адсорбцію з розчинів ПАР при постійній температурі?
4. Які нові особливості (явища) виникають при адсорбції з розчинів електролітів? Поясніть відповідь.
5. Одержати рівняння Гіббса. За яких умов воно застосовується?
6. Обчислити питому поверхню золю активованого вугілля, якщо Г¥ ізопропілового спирту у воді дорівнює 6 10-3 моль/кг, а S1 = 20,5. 10-20 м2.
7. Знайти адсорбцію пропіонової кислоти на поверхні поділу повітря - водний розчин при Т = 273 К та концентрації 0,5 моль/м3 за рівнянням Шишковського
Ds = 12,5.10-3 ln(1 + 7,73С) . (3.4)
8. Обчислити адсорбцію масляної кислоти на поверхні поділу повітря - водний розчин при Т = 283К та концентрації С = 0,104 кмоль/м3 за даними табл. 7 графічним способом.
Таблиця 7
| Концентрація С, кмоль/м3 | 0,00 | 0,021 | 0,050 | 0,104 | 0,246 | 0,489 |
| Поверхневий натяг s, мДж/м2 | 74,01 | 69,51 | 64,30 | 59,85 | 51,09 | 44,00 |
Розділ 3. Стійкість та коагуляція дисперсних систем
Дата добавления: 2015-02-16; просмотров: 1101;


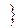 1/Г¥b DС
1/Г¥b DС С
С