Експериментальна частина. 1. Розподільну воронку 1 (рис
1. Розподільну воронку 1 (рис. 7) заповнити водою (треба стежити, щоб вона не потрапила до трубки 2).
2. Зняти пробірку 3. Заповнити її водою (якщо капіляр забруднений, промити його хромовою сумішшю і знову надіти).
3. Трохи відкривши кран 4, пропустити повітря при закритому крані 5.
4. Закрити кран 4, відкрити кран 5, щоб хромова суміш проникла до капіляру. Цю операцію повторити кілька разів. Потім злити хромову суміш до колби.
5. Промити пробірку та капіляр кількома порціями дистильованої води, як описано в пп. 2-4. При останньому промиванні зняти пробірку при закритому крані 4.
6. Залити стандартну рідину (дистильовану воду) у пробірку 3 до мітки, край капіляра при цьому повинен стикатися з поверхнею.
7. Обережно ледь відкрити кран 4 й встановити з його допомогою швидкість проскоку бульбашок повітря з інтервалом 3-5 секунд. Записати середнє значення максимального рівня рідини в манометрі 7.
8. Повторити операції, описані в пп. 6, 7, з розчинами, що вивчаються. Виміри проводити у порядку зростання концентрацій розчинів та в порядку збільшення вуглеводневого ланцюга молекул ПАР.
3.Обробка результатів
Перевірка правила Дюкло-Траубе
1. Розрахувати поверхневий натяг за формулою s=sоР/Ро.Записати дані в табл. 3.
Таблиця 3
| Найменування ПАР | С, моль/л | Р, см | s, мДж/м2 |
2. За отриманими даними побудувати ізотерми s = f(С) для всіх розчинів, що вивчалися.
3. Провести дотичні до кожної з кривих в точці С = 0 (σ = σ0), як показано на рис 4. Розрахувати поверхневі активності gn, gn+1 як кутові коефіцієнти дотичних за формулою
gn=tga = 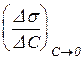 . (2.5)
. (2.5)
4. Перевірити правило Дюкло-Траубе, для чого розрахувати відношення gn / gn+1 для двох сусідних членів гомологічного ряду та порівняти отримані значення з теоретичними.
Розрахунок параметрів молекул ПАР (без застосування ПОЕМ)
1. Побудувати ізотерму s=f(С) ПАР. Експериментальні точки з`єднати так, щоб крива була плавною і експериментальні точки розподілялися з обох боків кривої рівномірно.
2. За отриманою ізотермою s = f(С) розрахувати адсорбцію (Г) ПАР для вибраних концентрацій за рівнянням Гіббса
Г = 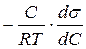 . (2.6)
. (2.6)
Щоб використовувати це рівняння, треба знати значення співвідношення 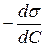 для обраних конкретних концентрацій розчинів. Для визначення цих величин розбивають криву вертикальними лініями з інтервалом концентрацій 0,05 моль/л (рис. 8). Приймають, що в межах цих інтевалів поверхневий натяг лінійно залежить від концентрації ПАР, і
для обраних конкретних концентрацій розчинів. Для визначення цих величин розбивають криву вертикальними лініями з інтервалом концентрацій 0,05 моль/л (рис. 8). Приймають, що в межах цих інтевалів поверхневий натяг лінійно залежить від концентрації ПАР, і 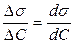 . Знаходять Ds1, Ds2, Ds3 і т. д. і розраховують значення
. Знаходять Ds1, Ds2, Ds3 і т. д. і розраховують значення
                 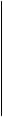
 s
s1
s2
s3
С1 С2 С3 С4 С5 С6 С7 С8 C
Рис.8. Обробка ізотерми поверхневого натягу для розрахунку величини адсорбції Г s
s1
s2
s3
С1 С2 С3 С4 С5 С6 С7 С8 C
Рис.8. Обробка ізотерми поверхневого натягу для розрахунку величини адсорбції Г
|
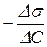 для 8 –10 концентрацій. Якщо DС=0,05, то g =
для 8 –10 концентрацій. Якщо DС=0,05, то g = 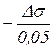 = 20
= 20 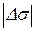 , звідки
, звідки
Г = 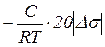 . (2.7)
. (2.7)
Одержані дані записують у табл. 5.
Таблиця 5
| С, моль/л | s, мДж/м2 | Г, моль/см2 | С/Г | Г¥, моль/см2 | S1, Å2 | l, Å | d, Å |
3. Розрахувати граничну адсорбцію ПАР (Г¥). Для цього використати лінеаризоване рівняння Ленгмюра:
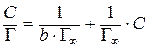 . (2.8)
. (2.8)
Побудувавши графік у координатах С/Г від С, знайти кутовий коефіцієнт нахилу прямої К = DС/D(С/Г), який дорівнює величині граничної адсорбції Г¥.
4. За значенням Г¥. розрахувати параметри молекул ПАР. Площу, яку займає одна молекула (S1), та довжину молекули (l) розрахувати за формулами
S1= 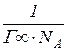 , l = Г¥М/r. (2.9)
, l = Г¥М/r. (2.9)
У цих рівняннях r та М - густина і молярна маса ПАР, NА - стала Авогадро.
5. За значеннями довжин молекул l(n+1) і ln розрахувати довжину d зв`язку С-С за такою формулою:
d = l(n+1) - ln (2.10)
Приклад розрахунку параметрів молекули ПАВ за допомогою ПЕОМ наведений в додатку 2.
Контрольні запитання та завдання
1. Пояснити, чому виникає поверхнева енергія та поверхневий натяг.
2. Чим пояснити, що зі зростанням температури поверхневий натяг зменшується?
3. На яких принципах базується визначення поверхневого натягу за методом найбільшого тиску бульбашок газу?
4. Дати визначення поверхневої активності. Як знайти її експериментально?
5. Сформулювати правило Дюкло-Траубе та обгрунтувати його.
6. Розрахувати питому поверхню золю арсену(ІІІ) сульфіду, середній діаметр частинок якого дорівнює 1,2.10-7м, а густина r = 3,43 г/см3.
7. Знайти поверхневий натяг гліцерину, якщо в капілярі з радіусом 4.10 -4см він піднявся на висоту 26,8 см. Густина гліцерину r = 1,26 г/см3.
8. Визначити, наскільки зменшиться запас вільної поверхневої енергії водяного туману, якщо радіус його крапель збільшиться з 1,5.10-5 до 1,2.10-3 м при Т = 288 К.
9. Розрахувати поверхневий натяг аніліну на межі з повітрям при Т = 292 К, якщо методом найбільшого тиску бульбашок газу встановлено, що тиск бульбашки при проскакуванні її у воду складає 1182 Па, а в анілін - 712 Па. Поверхневий натяг води 72,75 мДж/м2.
Дата добавления: 2015-02-16; просмотров: 997;
