Лабораторна робота 1
1. Понятие и элементы механизма правового регулирования.
2. Эффективность правового регулирования.
1. Понятие и элементы механизма правового регулирования. Механизм правового регулирования - это система юридических средств (юридических инструментов, с помощью которых удовлетворяются интересы субъектов права, обеспечивается достижение поставленных целей), организованных наиболее последовательным образом в целях преодоления препятствий, стоящих на пути удовлетворения интересов субъектов права.
Цель механизма правового регулирования заключается в обеспечении беспрепятственного движения интересов субъектов к ценностям (содержательный признак). Механизм правового регулирования - это система различных по своей природе и функциям юридических средств (формальный признак).
Можно выделить следующие элементы механизма правового регулирования:
1) норма права - в ней устанавливается модель удовлетворения интересов;
2) юридический факт или фактический состав с таким решающим фактом, как организационно-исполнительный правоприменительный акт;
3) правоотношение - нормативные требования здесь конкретизируются для соответствующих субъектов;
4) акты реализации прав и обязанностей - действия субъектов в форме соблюдения, исполнения и использования;
5) охранительный, правоприменительный акт - употребляется в случае правонарушения.
2. Эффективность правового регулирования - это соотношение между результатом правового регулирования и стоящей перед ним целью.
Можно выделить следующие пути повышения эффективности правового регулирования:
1. Совершенствование правотворчества, в результате которого в нормах права, с учетом высокого уровня законодательной техники, наиболее полно выражаются общественные интересы и те закономрености, в рамках котрых они будут действовать. Здесь нужно создавать с помощью соответствующих юридических и информационных средств такое положение, когда соблюдение закона буде выгоднее его нарушения.
2. Совершенствования правоприменения дополняет действенность нормативного регулирования. Правоприменение учитывает конкретную обстановку, своеобразие сочетание
ВСТУП
Колоїдна хімія вивчає властивості дисперсних систем та поверхневі явища. Дисперсна система складається із роздрібнених частинок речовини (дисперсної фази), розподілених в однорідному середовищі іншої речовини (дисперсійному середовищі). За агрегатним станом дисперсна фаза і дисперсійне середовище можуть бути рідкими, газоподібними або твердими. Частинки дисперсійної фази з розмірами 1-100 нм (10-7-10-5 см) утворюють систему колоїдної дисперсності, тобто золі.
Дисперсні системи надзвичайно поширені в природі. Можна сказати, що вся природа – гідросфера і атмосфера, земна кора, її надра, організми рослин і тварин - це складна сукупність грубо- та високодисперсних систем. Такі системи мають важливе значення і в повсякденному житті людини. Продукти харчування та сировина, з якої вони виробляються, (борошно, хліб, кофе-порошок, сік, сири), побутові товари (миючі засоби, фарби, пасти), будівельні матеріали (цемент, алебастр, крейда) – все це приклади колоїдних систем.
Усі золі являють собою високодисперсні гетерогенні системи і характеризуються великими значеннями питомої поверхні та поверхневої енергії. Тому колоїдні системи термодинамічно нестійкі, їх частини самодовільно можуть укрупнюватись шляхом коагуляції (злипання). Для збереження агрегативної стійкості колоїдних систем уводять третій компонент - стабілізатор. Ним можуть бути різні електроліти, мила, миючі речовини, деякі високомолекулярні сполуки.
У запропонованих у цьому посібнику теоретичниз відомостях та лабораторних роботах розглядаються питання властивостей поверхневих шарів (міжфазних границь, молекулярно-кінетичних, електричних та реологічних властивостей колоїдів), а також виявлення умов, що викликають коагуляцію дисперсних систем або забезпечують їх стабільність.
Програми колоквіумів
Колоквіум 1
1. Поверхневі явища
Колоїдна хімія, її предмет. Особливості дисперсного стану. Класифікація дисперсних систем.
1.1 Поверхнева енергія і поверхневий (міжфазний) натяг
Природа поверхневої енергії і міжфазного натягу, їх виникнення. Самочинні процеси на міжфазній поверхні.
Фактори, які впливають на міжфазний натяг. Повна поверхнева енергія.
Поверхнево-активні (ПАР) і поверхнево-інактивні (ПІР) речовини, їх вплив на поверхневий натяг. Дифільність ПАР, їх орієнтація на міжфазній поверхні. Залежність поверхневого натягу від концентрації ПАР, рівняння Шишковського. Поверхнева активність. Правило Дюкло-Траубе.
1.2 Міжфазні взаємодії
Змочування. Крайовий кут, рівняння Юнга. Адгезія і когезія, робота адгезії, рівняння Дюпре і Дюпре-Юнга. Умови розтікання рідини, коефіцієнт Гаркінса.
Гідрофілізація та гідрофобізація поверхні, їх застосування. Флотація.ю фізико-хімічні основи флотаційного збагачення руд.
1.3 Вплив дисперсності на властивості тіл
Вплив кривизни поверхні на на внутрішній (капілярний) тиск, рівняння Лапласа. Зміна рідини в капілярі, рівняння Журена. Капілярна конденсація, роль капілярних явищ і їх використання.
Тиск над малими краплями, рівняння Томпсона (Кельвіна). Ізотермічна перегонка.
Методи визначення поверхневого натягу.
2. Адсорбція і адсорбційні рівноваги
2.1 Адсорбція з газової фази
Сорбція, її види. Адсорбція, теплота адсорбції. Ізотерма адсорбції, кількісне визначення адсорбції. Природа адсорбційної взаємодії, потенціальна енергія взаємодії при адсорбції.
Адсорбція на межі поділу розчин-газ. Рівняння адсорбції Гіббса (виведення і аналіз).
Адсорбція на межі поділу тверде тіло-газ. Типи експериментальних ізотерм адсорбції. Ізотерма Генрі. Адсорбція не неоднорідній поверхні. Ізотерма Фрейндліха, знаходження параметрів рівняння.
2.2 Теорії адсорбції
Теорія мономолекулярної адсорбції на твердих адсорбентах. Ізотерма Ленгмюра (вихідні положення і виведення). Аналіз рівняння адсорбції Ленгмюра, коефіцієнт (константа)) адсорбції. Визначення параметрів адсорбата і адсорбента.
Полімолекулярна адсорбція. Рівняння адсорбції БЕТ, його аналіз. Визначення параметрів ПАР і теплоти адсорбції на основі ізотерми БЕТ.
2.3 Адсорбція із розчинів
Адсорбція на поверхні тверде тіло-розчин. Молекулярна адсорбція. Правило вирінювання полярностей. Адсорбція іонів (електролітів). Вибіркова адсорбція іонів. Правило Фаянса-Пескова. Ліотропні ряди.
Обмінна адсорбція іонів (іонний обмін). Іоніти. Обмінна ємність, рівняння ізотерми іонного обміну (Нікольського). Застосування іонообмінної адсорбції. Демініралізація води. Іонний обмін у грунтах. Основи адсорбційної хроматографії, її застосування.
Колоківум 2
3. Властивості дисперсних систем
3.1 Молекулярно-кінетичні властивості
Дифузія в дисперсних системах. Рівняння Фіка. Коефіцієнт дифузії. Рівняння Ейнштейна-Стокса.
Броунівський рух. Середньоквадратичне зміщення дисперсної частинки. Рівняння Ейнштейна-Смолуховського.
Осмос в дисперсних системах. Рівняння Вант-Гоффі і Коршака-Галлера. Визначення молярної маси ВМС за значенням осмотичного тиску.
Седиментація та агрегативна стабільність дисперсних систем. Седиментаційно-дифузійна рівновага, рівняння Перрена-Больцмана. Седиментація, рівняння Стокса для швидкості седиментації. Седиментаційний аналіз полідисперсних систем.
3.2 Оптичні властивості золей та оптичні методи їх дослідження
Розсіювання світла в колоїдних системах. Ефект Тіндаля. Рівняння Релея. Приклади прояву та застосування оптичних властивостей дисперсних систем.
Оптичні методи дослідження колоїдних систем. Ультрамікроскопія. Нефелометрія.
3.3 Структурно-механічні (реологічні) властивості
В’язкість колоїдних систем. Залежність в’язкості від температури і концентрації дисперсної фази. Способи визначення в’язкості.
Течія і в’язкість структурованих систем. Реологічна крива структурованої рідини, її основні ділянки. Залежність ефективної в’язкості від напруги зсуву.
В’язкість розчинів ВМС, рівняння Штаудінгера і Марка-Куна-Хаувінка. Визначення молярної маси ВМС за в’язкістю розчинів.
3.4 Електричні властивості та електрокінетичні явища
Виникнення подвійного електричного шару (ПЕШ) на межі поділу фаз та його будова. Дифузійний шар, його товщина. Електрокінетичний (дзета) потенціал. Вплив різних факторів на величину дзета-потенціалу. Перезарядка поверхні.
Утворення міцели гідро золю, її будова. Заряд частинки, потенціал визначальні іони та проиіони.
Електрокінетичні явища: електроосмос, електрофорез. Рівняння Гельмгольца-Смолуховського для швидкості електрофоретичного та електроосмотичного переносу. Потенціал протікання та осідання (седиментації). Використання електрокінетичних ефектів у суспільному виробництві. Способи визначення величини електрокінетичного потенціалу.
4. Стійкість і коагуляція дисперсних систем
4.1 Фактори коагуляції і стійкості
Фактори агрегативної стійкості. Коагуляція, стадії і швидкість коагуляції. Кінетика швидкої коагуляції за Смолуховським, константа коагуляції. Повільна коагуляція, фактор стабільності.
Висновки із теорії стійкості гідрофобних систем ДЛФО. Потенціальні криві взаємодії колоїдних частинок. Сили протягування і відштовхування, потенціальний бар’єр. Ближня і дальня взаємодії. Коагуляційні та конденсаційно-кристалізаційні структури.
Коагуляція під дією електролітів. Поріг коагуляції. правило коагуляції Шульце-Гарді. Коагуляція золів сумішами електролітів. Концентраційна і нейтралізаційна коагуляції. Прояви в природі та застосування електролітної коагуляції. Зворотність коагуляції. Тіксотропія, пептизація.
Стійкість ліофобних колоїдів з молекулярними адсорбційними шарами. Стабілізація колоїдів. Колоїдний захист. Захисне число. Адсорбційно-сольватний бар’єр.
4.2 Методи одержання і очищення золів.
Основні методи одержання колоїдних систем (диспергаційні, конденсаційні, хімічні).
Методи очищення золів (діаліз, електродіаліз, ультрафільтрація).
5. Окремі класи дисперсних систем
5.1 Розчини ПАР (ліофільно-міцелярні системи)
Міцелоутворення в розчинах ПАР. Іоногенні і неіоногенні ПАР. Гідрофільно-ліпофільний баланс.
Механізм міцело утворення Критична концентрація міцелоутворення (ККМ). Способи її визначення. Фактори, що впливають на ККМ. Солюбілізація. Мила, механізм миючої дії мил.
5.2 Розчини ВМС
Структурні типи ВМС. Властивості розчинів ВМС. Пластифікація. Набухання, його кінетика і механізм. Гелі і драглі.
5.3 Мікрогетерогенні грубодисперсні системи
Аерозолі, піни, емульсії, суспензії. Їх особливості, властивості, застосування.
Розділ 1. Дисперсійний аналіз суспензій
Лабораторна робота 1
Седиментаційний аналіз полідисперсних систем
Мета роботи: ознайомлення з методом седиментаційного аналізу, визначення фракційного складу полідисперсних систем та побудова кривої розподілу частинок дисперсної фази за розмірами.
1. Основні теоретичні положення
У виробничій практиці та побуті часто використовуються суспензії, грубодисперсні системи з частинками різних розмірів. Для аналізу систем з розмірами частинок від 1 до 100 мкм найчастіше використовують седиментаційний метод, який базується на визначенні швидкості осідання чи спливання частинок у рідинному середовищі. Якщо густина речовини дисперсної фази перевищує густину дисперсійного середовища, то частинки осідають зі швидкістю Vc, яка залежить від їх розмірів (маси) та властивостей середовища й описується рівнянням Стокса
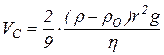 . (1.1)
. (1.1)
Визначивши швидкість осідання частинок Vc = h/t, за рівнянням Стокса, легко розрахувати радіус r частинок дисперсної фази:
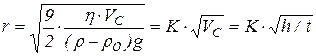 , (1.2)
, (1.2)
де h - в’язкість середовища (h(Н2О)=10-3 Па.с), r та r0 - густина речовини дисперсної фази та середовища відповідно (r0(Н2О) = 1 кг/л), g - прискорення вільного падіння (9,8 м/с2), h - відстань, пройдена частинками за час t (висота стовба осідання).
Для визначення швидкості осідання дисперсної фази в рідинному середовищі використовують седиментометри, які існують у кількох варіантах (Фігуровського, Робінсона, Ребіндера, Вігнера тощо). Використання кожного з них дозволяє виявити змінність маси m дисперсної фази як функції часу t осідання, і побудувати седиментаційну криву (рис. 1). Будь-яка точка кривої седиментації показує масу речовини, яка осіла за даний проміжок часу t. Завдання зводиться до того, щоб із загальної маси осадженої речовини виділити масову частку фракцій, які повністю випали, та визначити їх розміри.
У роботі використовується седиментометр Вігнера (рис. 2), принцип дії якого базується на зміні гідростатичного тиску в процесі седиметації. Седиментометр складається з циліндра (1), у якому знаходиться суспензія, та похило встановленого манометра (2), куди затягується лише дисперсійне середовище. Седиментація призводить до зміни питомої ваги суспензії, що зменшує тиск стовпчика суспензії та викликає переміщення меніска рідини в манометрі.
Оскільки переміщення меніска Dl відповідає зміні маси суспензії Dm в результаті осідання частинок дисперсної фази, то за даними експерименту будують криву осідання полідисперсної системи (седиментаційну криву) l (або m) від t (див. рис. 1). Час t1 відповідає моменту повного осідання найкрупніших частинок, а t¥ - часу осідання найдрібніших частинок, здатних до седиментації.
Дата добавления: 2015-02-16; просмотров: 1879;
