Експериментальна частина
1. Одержати золь шляхом заміни розчинника. До 1 мл 2-%-го спиртового розчину каніфолі додати 20 мл води. Визначити забарвлення золю у падаючому та відбитому світлі.
2. Одержати золь гидроксиду заліза (ІІІ) методом гідролізу. Нагріти до кипіння 50 мл дистильованої води. Додати 10 мл 2-%-го розчину хлориду заліза (ІІІ) та кип`ятити ще кілька хвилин.
3. Одержати золь Fe(OH)3 методом пептизації. До 5 мл 1М розчину FeCl3 у колбі на 250 мл додати 100 мл води. Осадити Fe3+ невеликим надлишком розчину аміаку . Колбу заповнити водою доверху. Дати осадові відстоятися. Осадок багато разів декантувати до зникнення запаху аміаку. Об’єм розчину довести до 150 мл. Додати пептизатор - 15-20 крапель насиченого розчину FeCl3. Нагріти розчин на водяній бані, збовтуючи його. Якщо осадок залишиться, додати ще кілька крапель пептизатора, продовжуючи нагрівати.
4. Одержати золь берлінської блакиті методом подвійного обміну. Приготувати у двох пробірках колоїдні розчини берлінської блакиті з 0,005 н FeCl3 і 0,005 н K4[Fe(CN)6] у таких співвідношеннях:
1) 3 мл FeCl3 + 1 мл K4[Fe(CN)6];
2) 1 мл FeCl3 + 3 мл K4[Fe(CN)6].
5. Одержати золь металевого срібла. Азотнокисле срібло легко відновлюється в лужному середовищі. Внести пипеткою 1 мл розчину AgNO3 (С = 0,1 н) у 100 мл дистильованої води. Додати 2-3 краплини 1%-го розчину К2СО3 і 1,0 мл свіжоприготовленого 0,1%-го розчину таніну та підігріти.
При нагріванні інтенсивність забарвлення зростає.
6. Одержати золь діоксиду марганцю. До 1 мл 1,5%-го розчину КМnО4 у пробірці додати 10 мл води. По краплях з пипетки ввести 0,5 мл 1%-го розчину тіосульфату натрію.
7. Визначити масову частку золю каніфолі нефелометричним методом:
а) приготувати початкові розчини золю каніфолі. У чотири мірних колби на 100 мл вливають 2 мл; 1,5 мл; 1 мл; і 0,5 мл 2%-го спиртового розчину каніфолі. Дистильованою водою доводять рівень рідини до відмітки та отримують відповідно розчини золю каніфолі з масовими частками: 4%; 3%; 2%; 1% (стандартні розчини);
б) визначити оптичну густину (Д) стандартних розчинів золю каніфолі на фотоколориметрі (нефелометрі) КФК-2 при довжині хвилі l = 400 нм. Вимірювання оптичної густини золю каніфолі проводять у скляних кюветах з товщиною шару l=1 см відносно дистильованої води. (Порядок роботи з КФК-2 наводиться в інструкції до прибору). Дані записуються в табл. 11;
в) виміряти оптичну густину розчину, що вивчається.
3. Обробка результатів
1. Для пп. 2-6 записати рівняння реакцій та формули міцел золів. Для золю, одержаного шляхом гідролізу, вказати іон-стабілізатор.
2. Для визначення масової частки золю нефелометричним методом побудувати калібровочний графік залежності оптичної густини (Д) від масовлї частки стандартних розчинів (w, %) за даними табл. 11.
3. Визначити масову частку золю каніфолі, користуючись величиною оптичної густини розчину, що вивчається, за калібровочним графіком.
Таблиця 11
| w, % | ||||
| Д (l = 400 нм.) |
Контрольні запитання та завдання
1. За якими ознаками проводять класифікацію дисперсних систем?
2. У чому полягає сутність методів одержання колоїдних систем: конденсаційного; диспергаційного; хімічного; гідролізного; методу реакцій подвійного обміну? Навести приклади.
3. Чому змінюється забарвлення золів у падаючому та відбитому світлі?
4. Наведіть будову подвійного електричного шару за теоріями Гельмгольца, Гуї та Чепмена, Штерна.
5. Запишить міцелу золю AgCl, отриманого внаслідок реакції
AgNO3(надлишок) + KCl®...
6. Запишить міцелу золю As2S3, отриманого внаслідок наступної реакції
AsCl3 + H2S (надлишок)®...
7. Золь йодиду срібла, отриманий при додаванні до 20 мл розчину КJ (С = 0,01 н) 15 мл 0,2%-го розчину AgNO3 (густина r = 1 г/см3). Який заряд має золь? Наведіть будову міцели.
Розділ 4. Міцелоутворення у водних розчинах поверхнево-активних речовин (ПАР)
Лабораторна робота 6
Визначення критичної концентрації міцелоутворення
Мета роботи: визначення критичної концентрації міцелоутворення (ККМ) лаурілсульфонату натрію методом вимірювання поверхневого натягу на межі поділу фаз «рідина-повітря» та кондуктометричним методом.
1. Основні теоретичні положення
Ліофільні дисперсні системи являють собою термодинамічно стабільні системи. Це означає, що вони зворотні і утворюються як з макрофази, так і з розчину самовільно.
Ліофільні системи можуть бути тільки ультрамікрогетерогенними з дуже малим поверхневим натягом (1 10-4 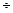 1,4 мДж/м2). До них відносять асоціативні колоїди (розчини колоїдних поверхнево-активних речовин (ПАР)) та розчини полімерів (ВМР). У розчинах колоїдних ПАР частинки (міцели) виникають внаслідок асоціації діфільних молекул (_
1,4 мДж/м2). До них відносять асоціативні колоїди (розчини колоїдних поверхнево-активних речовин (ПАР)) та розчини полімерів (ВМР). У розчинах колоїдних ПАР частинки (міцели) виникають внаслідок асоціації діфільних молекул (_ 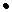 ) (Рис. 11). Це більш вигідний процес, ніж виникнення нової фази. Здатність ПАР до утворення міцел значною мірою залежить від довжини вуглеводневого ланцюга ПАР. Так, ПАР з невеликими
) (Рис. 11). Це більш вигідний процес, ніж виникнення нової фази. Здатність ПАР до утворення міцел значною мірою залежить від довжини вуглеводневого ланцюга ПАР. Так, ПАР з невеликими
С6Н6 Н2О
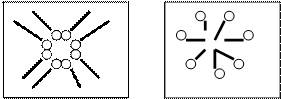 Рис. 11. Виникнення міцел ПАР
у різних середовищах
Рис. 11. Виникнення міцел ПАР
у різних середовищах
|
Н2О
Рис. 12. Схема процесу солюбілізації |
ланцюгами (нижчі спирти, кислоти та їх солі) знаходяться в розчині у молекулярно-дисперсному стані за будь-яких концентрацій. Такі ПАР називають істинно розчинними. Вони застосовуються як змочувальні речовини, диспергатори, піноутворювачі. ПАР, здатні утворювати міцели в розчинах, називають колоїдними. Вони мають великі вуглеводневі ланцюги радикалів, від довжини яких залежить концентрація, вище якої виникають міцели (критична концентрація міцелоутворення). Чим довший вуглеводневий ланцюг радикалу, тим нижча розчинність і тим менша ККМ.
Між міцелами та розчином встановлюється рівновага.
 l
p
t
s
Зона ККМ С
Рис. 13. Залежність каламутності (t), осмотичного тиску (p), поверхневого натягу (s) та молярної електропровідності (l) від концентраці ПАР (С)
l
p
t
s
Зона ККМ С
Рис. 13. Залежність каламутності (t), осмотичного тиску (p), поверхневого натягу (s) та молярної електропровідності (l) від концентраці ПАР (С)
|
При концентраціях, трохи більших за ККМ, міцели мають сферичну форму. З ростом концентрації виникають більш великі міцели циліндричної, дископодібної, паличкоподібної або пластівчастої форми. Після цього можуть виникати рідинно-кристалічні структури.
Розчини колоїдних ПАР здатні до солюбілізації, тобто в них швидко зростає розчинність речовин, які до того у цьому розчиннику майже не розчинялись. Розчинність збільшується завдяки проникненню молекул розчинюваної речовини в середину міцели (явище солюбілізації) (рис. 12).
Значення ККМ зменшується також із зменшенням гідратації протиіонів (якщо ПАР - електроліт).
Існує багато способів визначення ККМ. Усі вони базуються на зміні фізико-хімічних властивостей розчинів ПАР при утворенні міцел (рис. 13).
2.Експериментальна частина
1. Взяти в лаборанта 10 розчинів лаурілсульфонату натрію.
2. Ознайомитись із методом вимірювання поверхневого натягу (див. роботу 2) та провести вимірювання. Дані (Р) записати до табл. 12.
3. Виміряти опір цих розчинів (дивись інструкцію до приладу), занести дані у табл. 12. Окрім того, вимірити опір 0,02 н. розчину КСl.
Таблиця 12
| № розчину | w,% | 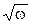
| lgw | Р, см | s, мДж/м2 | R, Ом | c, Ом-1см-1 |
3. Обробка результатів
1. Розрахувати значення поверхневого натягу s за значеннями Р (див. роботу 2).
2. За даними табл. 12 побудувати графік s=f(lgw) та визначити ККМ.
3. За значеннями R з табл. 12 розрахувати питому електропровідність кожного розчину ПАР, користуючись значеннями R та c стандартного розчину КСl:
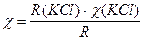 . (6.1)
. (6.1)
4. Побудувати графік c = f( 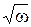 ) та визначити за ним ККМ.
) та визначити за ним ККМ.
Контрольні запитання та завдання
1. У чому відмінність колоїдних ПАР від дійсно розчинних?
2. Дайте визначення поняття критичної концентрації міцелоутворення.
3. Що мають на увазі, коли кажуть, що у розчинах ПАР почалось міцелоутворення? Які умови перебігу цього процесу?
4. Навести відомі вам методи визначення ККМ. Чому після міцелоутворення поверхневий натяг, осмотичний тиск та опір практично не змінюються, а каламутність швидко зростає?
5. Які фактори впливають на ККМ? Коли і як впливає довжина вуглеводневого радикалу ланцюга на утворення міцел у розчинах ПАР?
6. Від яких чинників залежить форма міцел у розчинах колоїдних ПАР?
7. Дайте визначення явища "солюбілізація". Чим зумовлене це явище? Де і як його використовують?
8. ККМ додецилсульфату натрію при t0 20о, 40о та 600 С складає відповідно 1,51.10-3, 1,62.10-3 та 1,87.10-3 моль/л. Обчислити стандартну теплоту, енергію Гіббса та енергію міцелоутворення при t0 200 С.
9. За даними табл. 13 обчислити ККМ ПАР та число агрегації міцели олеату калію за даними осмотичного методу (на осі абсцис краще відкладати 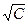 ).
).
Таблиця 13
| С.102, кмоль/м3 | 1,6 | 6,4 | 14,4 | 25,6 | |
| Осмотичний коефіцієнт (f0) | 0,9 | 0,26 | 0,18 | 0,13 | 0,10 |
Розділ 5. Властивості високомолекулярних речовин (ВМР)
та їх розчинів
Дата добавления: 2015-02-16; просмотров: 1250;