Химическая кинетика и катализ. Ферменты – катализаторы (ускорители) всех биохимических реакций, в реакциях они не расходуются
Ферменты – катализаторы (ускорители) всех биохимических реакций, в реакциях они не расходуются.
Скорости химических реакций зависят от температуры. Формула Аррениуса для константы скорости реакции.
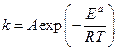
где 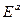 - энергия активации, характеризующая барьер, который частица должна преодолеть для осуществления реакции.
- энергия активации, характеризующая барьер, который частица должна преодолеть для осуществления реакции.
Эта формула следует из распределения Больцмана по энергиям; экспонента указывает на долю молекул, обладающих достаточной для реакции энергией активации  при данной температуре T. k – определяет скорость реакции.
при данной температуре T. k – определяет скорость реакции.
В обратимой реакции скорости равны  и
и 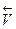 .
.
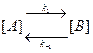 ,
,
где [A] и [B] – концентрации веществ А и В.
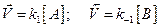 .
.
В равновесии 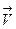 =
= 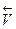 , и константа равновесия K =
, и константа равновесия K = 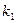 /
/ 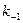
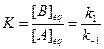 .
.
Разность свободных энергий продуктов реакции и исходных реагентов равна:
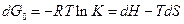 ;
;
где dH и dS – разность энтальпий и энтропий. Реакция возможна, если
dG < 0 (свободная энергия понижается).
Это необходимое условие, но не достаточное для реакции. 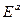 может быть большой, при этом константа скорости мала, и реакция не идет.
может быть большой, при этом константа скорости мала, и реакция не идет.
Катализатор служит для понижения активационного барьера, т.е. уменьшения разности между энергией фермент-субстратного комплекса и энергией активации реагентов.
 Эйринг предложил теорию абсолютных скоростей реакции (теория переходных состояний или активированного комплекса). При этом в теории вводятся следующие допущения:
Эйринг предложил теорию абсолютных скоростей реакции (теория переходных состояний или активированного комплекса). При этом в теории вводятся следующие допущения:
1. Предполагается, что ход реакции не нарушает больцмановского распределения молекул по состояниям с разной энергией.
2. Прохождение реакции требует преодоления энергетического барьера.
 dG =G1-G2 , dG- разность свободных энергий начального и конечного состояний.
dG =G1-G2 , dG- разность свободных энергий начального и конечного состояний.
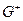 - свободная энергия активации в процессе 1
- свободная энергия активации в процессе 1  2
2
Находят число систем, находящихся в некотором интервале δ реакционной координаты ξ на вершине барьера. Среднее время прохождения через барьер: 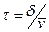 , где
, где 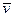 - средняя скорость перемещения частиц на вершине барьера.
- средняя скорость перемещения частиц на вершине барьера.
Скорость реакции — это число систем, преодолевающих энергетический барьер в единицу времени. Средняя скорость движения системы равна:
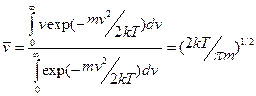 .
.
В уравнении (5) воспользовались распределением Максвелла-Больцмана по кинетическим энергиям 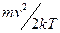 . Скорость реакции, т.е. число переходов через барьер в единицу времени:
. Скорость реакции, т.е. число переходов через барьер в единицу времени:
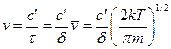 ,
,
где 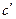 - число систем в единице объема, находящихся в пределах отрезка δ.
- число систем в единице объема, находящихся в пределах отрезка δ.
Вместе с тем
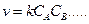
где 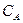 ,
, 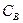 - концентрации реагентов
- концентрации реагентов
Из (6) и (7) имеем
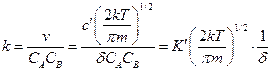 .
.
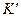 — константа равновесия для перехода реагентов A,B…. в активированное состояние.
— константа равновесия для перехода реагентов A,B…. в активированное состояние.
Константа равновесия выражается через статсуммы z:
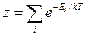
где 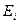 - энергия i-го состояния системы. Суммирование ведётся по всем состояниям. В нашем случае:
- энергия i-го состояния системы. Суммирование ведётся по всем состояниям. В нашем случае:
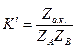
где 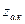 ,
, 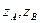 — статсуммы для активированного комплекса и реагентов.
— статсуммы для активированного комплекса и реагентов.
Для поступательного движения частицы набор состояний непрерывен, сумма (9) заменяется интегралом, который равен
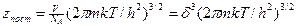
где h – постоянная Планка, m- масса частицы, 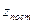 - это статсумма по трем степеням свободы поступательного движения.
- это статсумма по трем степеням свободы поступательного движения.
Т.к. система имеет только одну такую степень свободы — вдоль направления реакции, получаем
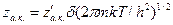
где 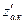 - статсумма для активированного комплекса по всем степеням свободы, кроме поступательной.
- статсумма для активированного комплекса по всем степеням свободы, кроме поступательной.
Из (8), (10), (12) получаем:
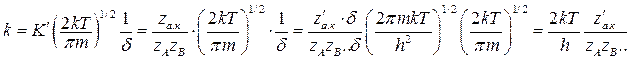
Условная длина сократилась
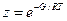
и, следовательно,
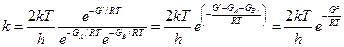
Здесь 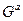 — избыток свободной энергии активированного комплекса по сравнению с суммарной свободной энергией реагентов, т.е. свободная энергия активации. При выводе (15) полагалось, что, достигнув активационного барьера, система обязательно вступит в реакцию. Этого может и не быть. Поэтому вводят трансмиссионный коэффициент χ ≤ 1
— избыток свободной энергии активированного комплекса по сравнению с суммарной свободной энергией реагентов, т.е. свободная энергия активации. При выводе (15) полагалось, что, достигнув активационного барьера, система обязательно вступит в реакцию. Этого может и не быть. Поэтому вводят трансмиссионный коэффициент χ ≤ 1
Тогда формула Эйринга для константы скорости гомогенной газовой реакции:
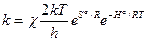
 ,
, 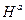 — энтропия и энтальпия активации. Условие χ = 1 отвечает адиабатическому течению реакции (т. е. когда параметры изменяются медленно); χ << 1 — для неадиабатического процесса (может достигать ~
— энтропия и энтальпия активации. Условие χ = 1 отвечает адиабатическому течению реакции (т. е. когда параметры изменяются медленно); χ << 1 — для неадиабатического процесса (может достигать ~ 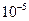 ). В газовых реакциях χ обычно стремится к 1 (т.е. реакции эти обычно адиабатичны; kT/h при обычных T ~
). В газовых реакциях χ обычно стремится к 1 (т.е. реакции эти обычно адиабатичны; kT/h при обычных T ~ 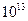
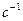 ).
).
Сравнивая (1) и (16) видим, (отождествляя энтальпию и энергию активации) что в формуле Аррениуса
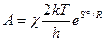
Значения параметров активации определяют по температурной зависимости k. При χ = 1
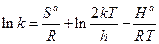
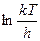 слабо зависит от T, и этим членом можно пренебречь. По наклону прямой lnk от 1/T находят
слабо зависит от T, и этим членом можно пренебречь. По наклону прямой lnk от 1/T находят 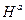 , а по отрезку, отсекаемому на оси ординат, —
, а по отрезку, отсекаемому на оси ординат, —  .
.
Нелинейность зависимости lnk от 1/T свидетельствует об усложнении процесса (о его кооперативности, в таком процессе 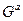 зависит от числа уже прореагировавших систем и тем самым от 1/T, т.е. не постоянна). Нельзя трактовать h/(kT) как время существования активированного комплекса, т.к. за
зависит от числа уже прореагировавших систем и тем самым от 1/T, т.е. не постоянна). Нельзя трактовать h/(kT) как время существования активированного комплекса, т.к. за 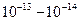 с не может установиться статистическое равновесие. В реальности время существования системы в состоянии, отвечающем значениям реакционной координаты от ξ до ξ + δ, пропорционально δ. Это время аналогично времени существования состояний в теории Максвелла-Больцмана. Из малости h/(kT) нельзя делать вывод о невозможности установления равновесия между активированным комплексом и реагентами. Термин "активированный комплекс" относится к атомной системе, претерпевающей превращения, и не означает состояние метастабильного комплекса.
с не может установиться статистическое равновесие. В реальности время существования системы в состоянии, отвечающем значениям реакционной координаты от ξ до ξ + δ, пропорционально δ. Это время аналогично времени существования состояний в теории Максвелла-Больцмана. Из малости h/(kT) нельзя делать вывод о невозможности установления равновесия между активированным комплексом и реагентами. Термин "активированный комплекс" относится к атомной системе, претерпевающей превращения, и не означает состояние метастабильного комплекса.
Теория Эйринга применима к реакциям в газах, но не в жидкой фазе. Общий метод качественного рассмотрения пригоден для различных кинетических процессов (диффузия, вязкое течение и т.д.).
В ряде случаев реакция идет без преодоления активационного барьера, посредством туннельного эффекта (квантовомеханического просачивания через барьер в реакциях переноса 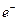 или протона). В этом случае скорость реакции практически не зависит от T).
или протона). В этом случае скорость реакции практически не зависит от T).
Дата добавления: 2015-02-07; просмотров: 1054;
