Глава 4. Физика ферментов.
4.1. Общая характеристика действия ферментов (определения)
1. Фермент (Е) — это белок, увеличивающий скорость биохимических реакций, т.е. работающий как катализатор (увеличивает скорость до 1010 раз).
2. Субстрат (S)—это молекула, которая после взаимодействия с ферментом Е превращается в продукт Р.
3. Активный центр фермента— это особый участок молекулы белка, с которым связывается субстрат S с образованием ФСК Е-S (почти всегда он построен из нескольких пространственно-сблизившихся АК-остатков, т.к. в линейной последовательности они могут быть расположены далеко друг от друга). Формирование E-S комплекса осуществляется слабыми взаимодействиями (Н-связями, солевыми мостиками, гидрофобными взаимодействиями), но иногда и ковалентными связями (сериновые протеазы образуют промежуточный продукт с помощью ковалентной связи).
4. Специфичность фермента — это его способность отличить свой собственный (истинный) субстрат от других родственных молекул. Избирательность обусловлена высокой специфичностью фермент-субстратных взаимодействий. Ранняя модель этого взаимодействия "замок (Е) - ключ (S)", аналог которой был предложен Фишером 100 лет назад: "к ферменту (замку) подходит только свой субстрат (ключ)", была дополнена моделью "индуцированного соответствия" Кошландом в 1959 году. Согласно этой общепризнанной гипотезе, связывание ферментом правильного субстрата индуцирует в белке небольшие конформационные изменения. В результате этих изменений каталитические группы фермента ориентируются таким образом, что становится возможным превращение субстрата в продукт (рис.1). Дальнейшее развитие модели индуцированного соответствия связано с учётом того, что конформация субстрата при связывании с ферментом также может слегка изменяться (Рис.2).
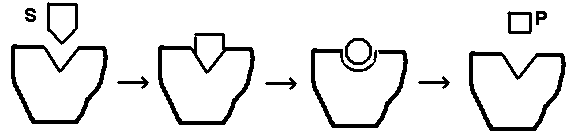
Рис.1. Модель фермент-субстратного взаимодействия “замок (Е)-ключ (S)”.
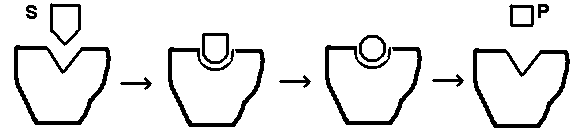
Рис.2. Индуцированное соответствие и напряжение в молекуле субстрата.
В этом случае говорят о напряжении в молекуле субстрата. Гипотеза о существовании конформационных изменений в ферменте и субстрате при их связывании друг с другом объяснила тот факт, что молекулы, очень похожие по форме на истинный субстрат, могут связываться с ферментом, но не превращаться в продукт, т.е. действуют как ингибиторы. Таким образом, правильный субстрат—это больше, чем просто “ключ” к соответствующему “замку”.
Специфичность узнавания у разных ферментов варьирует — некоторые ферменты могут катализировать реакцию с участием только одного субстрата, тогда как другие — с несколькими химически родственными веществами (формамидаза гидролизует только формамид, а амидаза гидролизует любой алифатический амид).
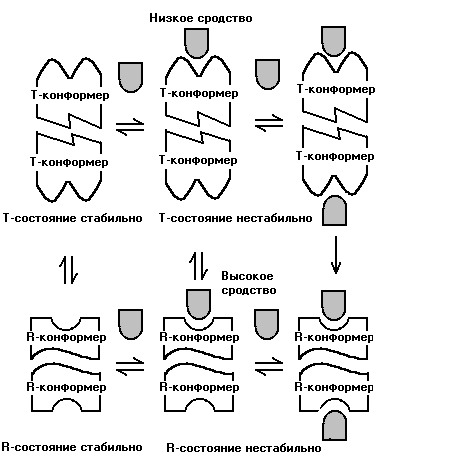
Рис.3. Структура ферментативных реакций.
5. Положение равновесия реакции не зависит от присутствия или отсутствия фермента в реакционной смеси. Свободная энергия реакции dG0 равна разности свободных энергий S и P и определяет положение равновесия реакции. В присутствии любого катализатора, в том числе и фермента, свободная энергия исходных реагентов (S) и продуктов реакции (P) не изменяется и, следовательно, не изменяется dG0 (Рис.4).
6. Переходное состояние, или активированный комплекс (обозначается Х) — это высокоэнергетическая промежуточная структура, которая образуется во время реакции. Разность свободных энергий реагентов (S) и переходного состояния называется свободной энергией активации и обозначается dGА. Скорость реакции зависит от величины dGА: чем она меньше, тем больше скорость реакции (Рис.4).
7. Фермент увеличивает скорость реакции следующими способами:
7.1. понижая свободную энергию переходного состояния путём стабилизации активированного комплекса;
7.2. увеличивая энергию субстрата (S), когда тот связывается с ферментом (E) при образовании ФСК (E-S). В итоге уменьшается разность свободных энергий E-S комплекса и переходного состояния;
7.3. поддерживая микроокружение активного центра (АЦ) в состоянии, отличном от такового в водной среде;
7.4. располагая реагирующие атомы в правильной ориентации, на необходимом расстоянии друг от друга так, чтобы обеспечить оптимальное протекание реакции.
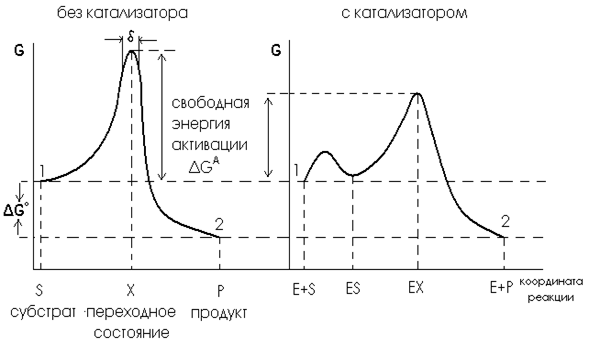
Рис.4. Изменение свободной энергии реакции с катализатором и без него.
8. Ингибиторами называются молекулы, которые, связываясь с ферментом, блокируют какую-то стадию ферментативной реакции. Ингибиторы бывают обратимыми и необратимыми. Обратимое ингибирование подразделяют на конкурентное, неконкурентное и бесконкурентное.
8.1. Конкурентный ингибитор — это молекула, похожая на субстрат S настолько, что фермент E не может их различить. В результате конкурентного ингибирования падает концентрация ФСК и, следовательно, скорость реакции. Ингибитор обычно в продукт не превращается.
8.2Неконкурентный ингибитор — это молекула, связывающаяся не с АЦ, а с каким-то другим участком фермента. Поскольку связывание с неконкурентным ингибитором не мешает ферменту образовывать ФСК, то этот ингибитор не понижает концентрацию таких комплексов, а влияет на эффективность превращения S в P.
8.3. Бесконкурентный ингибитор — это молекула, которая связывается только с ФСК и не может связываться со свободным ферментом. В односубстратных ферментных системах этот тип ингибирования редок.
8.4. Необратимый ингибитор непрерывно модифицирует молекулы фермента, в результате чего они частично или полностью теряют свою активность.
9. Регуляция активности фермента может осуществляться с помощью активного зимогена (профермента), ковалентной модификации, ингибирования по принципу отрицательной обратной связи, за счёт кооперативных или аллостерических эффектов.
9.1. Зимоген — это неактивный предшественник фермента. Чтобы зимоген превратился в активный фермент, какая-то часть его полипептидной цепи должна быть отщеплена. Например, в семействе сериновых протеаз химотрипсиноген и трипсиноген являются зимогенами химотрипсина и трипсина соответственно.
9.2. Ковалентной модификацией называется ковалентное присоединение или отщепление от фермента небольшой химической группы, регулирующее его активность. С помощью модификации либо полностью неактивная форма фермента становится активной, либо, наоборот, полностью активный фермент инактивируется. Например, гликоген-синтетаза, превращающая глюкозу в гликоген, инактивируется после ковалентного присоединения фосфатной группы к боковой цепи одного из сериновых остатков и снова активируется при отщеплении фосфата.
9.3. Ингибирование по принципу отрицательной обратной связи характерно для ферментных систем, в которых субстрат претерпевает несколько последовательных превращений, причём каждая реакция катализируется своим ферментом.

Ингибирование имеет место, если конечный продукт Т блокирует одну из ранних стадий в цепи реакций. А для этого продукт Т должен быть либо структурно похожим на S (т.е. действовать как конкурентный ингибитор), либо связываться с какой-либо другой частью фермента, регулируя т.о. его активность (т.е. выступая в роли неконкурентного ингибитора).
9.4. Кооперативные эффекты характерны для мультимерных белков, в том числе и для ферментов. Если имеет место кооперативный эффект, то кинетические свойства фермента уже не описываются уравнением Михаэлиса-Ментен: график зависимости v от [S] в этом случае представляет собой S-образную кривую, а не гиперболу, а график Лайнунвера-Берка перестаёт быть прямой. При этом небольшое увеличение концентрации [S] будет приводить к значительному возрастанию скорости реакции. Для объяснения этого эффекта были предложены модель МУШ (Моно, Уаймена и Шанжё), или симметричная модель, и последовательная модель (Кошланда, Нимети и Филмера).
В симметричной модели предполагается, что каждый мультимерный ферментный комплекс может существовать в двух разных состояниях с различной четвертичной структурой, причём в каждом состоянии все субъединицы имеют одинаковую третичную структуру. В простейшем случае (рис. 3) рассматриваются два состояния, находящиеся в равновесии друг с другом. В одном из них белок имеет высокое сродство к субстрату (R-состояние), в другом — низкое (T-состояние). Добавленный субстрат будет предпочтительно связываться с R-конформерами фермента, а связывание его с Т-конформером приведёт к возникновению напряжения в субъединицах фермента, что вызовет одновременный переход всех субъединиц (мономеров) в R-состояние, в котором напряжение отсутствует. При этом согласованном переходе сохраняется молекулярная симметрия каждой мультимерной молекулы. При дальнейшем добавлении субстрата всё большее количество молекул будет переходить из Т в R-состояние. Такой сдвиг равновесия в присутствии субстрата представляет собой эффект положительной кооперативности. В результате этого эффекта график зависимости v от [S] будет иметь S-образную форму.
В последовательной модели предполагается, что отдельные субъединицы мультимерной молекулы в одно и то же время могут иметь разные третичные структуры. Причём, связывание субстрата одной субъединицей может вызывать изменение третичной структуры соседней субъединицы и в результате увеличивать (положительная кооперативность) или уменьшать (отрицательная кооперативность) их сродство к субстрату.
9.5. Аллостерическая регуляция представляет собой эффект, когда небольшие молекулы (эффекторы), связываясь с ферментом ВНЕ области АЦФ, изменяют скорость реакции. Подобная регуляция может быть гомотропной, когда молекула S, взаимодействуя с Е, изменяет его сродство к молекулам того же S, и гетеротропной, когда сродство к S изменяется при взаимодействии Е с молекулой, не похожей на молекулу S. Гомотропные и гетеротропные эффекторы могут быть ингибиторами или активаторами. Аллостерический активатор, действующий на фермент, описываемый симметричной моделью, будет связываться предпочтительно с R-конфомером, стабилизируя это состояние. В результате активатор будет увеличивать начальную концентрацию R-конфомеров по сравнению с концентрацией Т-конформеров и, следовательно, увеличивать сродство фермента к своему субстрату (положительная кооперативность).
Аллостерический ингибитор, наоборот, предпочтительно связывает и стабилизирует фермент, находящийся в Т-состоянии, вызывая, таким образом, уменьшение сродства фермента к своему субстрату (отрицательная кооперативность).
В целом, роль аллостерических ферментов заключается в том, чтобы расширить (в случае ингибитора), либо сузить (в случае активатора) интервал концентрации субстрата, в котором фермент способен увеличивать скорость реакции.
10. Большая часть ферментов функционирует в комплексах с низкомолекулярными кофакторами, коферментами. Такой фермент в целом называется холоферментом, его белковая часть — апоферментом. Коферментами являются ионы металлов (например, Mg++). Среди алифатических кофакторов есть содержащие серу — это глутатион, линолевая кислота, есть и дифосфаты углеводов (участвуют в реакциях переноса фосфатных групп), витамины (играют каталитическую роль).
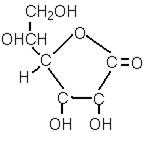
Рис.5. Витамин С (аскорбиновая кислота).
Большинство важнейших коферментов — π–электронные сопряжённые системы, содержат ароматические циклы, или гетероциклы (рибофлавины или витамин В2). Аденин входит в состав кобамидных ферментов, связанных с кобаламином (или В12).
11. Молекулярной активностью (или “числом оборотов”) фермента называют число молей субстрата, превращённых в продукт за одну минуту одним молем фермента при избытке субстрата (S>>E).
Дата добавления: 2015-02-07; просмотров: 2282;
