Кинетика простых ферментативных реакций
Превращение субстрата S в продукт P в одностадийном процессе:
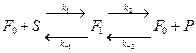 ;
; 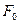 — свободный фермент,
— свободный фермент, 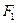 - ФСК.
- ФСК.
Для простоты пренебрегают обратной 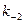 реакцией. Далее S, P,
реакцией. Далее S, P, 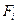 —будут концентрациями субстрата, продукта и фермент-субстратного комплекса без скобок [ ].
—будут концентрациями субстрата, продукта и фермент-субстратного комплекса без скобок [ ].
Кинетические уравнения имеют вид:
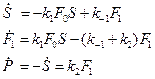
Общая концентрация фермента постоянна:
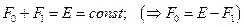
Из (19) и (20), исключая 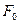 , получим:
, получим:
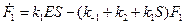
Система при S>>E находится в стационарном состоянии, где 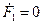 и. Тогда из (21) получим
и. Тогда из (21) получим
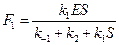
а из (19): 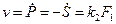 .
.
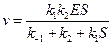
v —скорость реакции. Разделим на  числитель и знаменатель:
числитель и знаменатель:
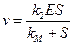
Уравнение (24) называется уравнением Михаэлиса-Ментенс константой Михаэлиса:
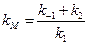 (24а)
(24а)
Зависимость v(S) подобна изотерме Ленгмюра:
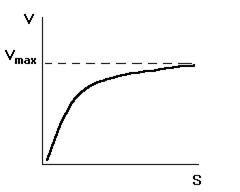
Рис.7. Кривая Михаэлиса-Ментен.
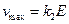
т.е.
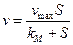
При 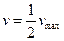 ,
, 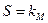 , т.е. константа Михаэлиса — это концентрация субстрата, при которой скорость реакции равна
, т.е. константа Михаэлиса — это концентрация субстрата, при которой скорость реакции равна 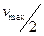 .
.
Преобразовав (26), получим:
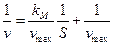
Строя график 1/v от 1/S, находим 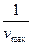 по точке пересечения прямой с осью ординат и
по точке пересечения прямой с осью ординат и 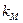 — по наклону прямой.
— по наклону прямой.
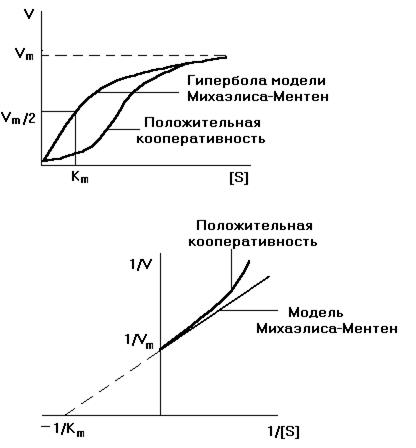
Рис.8. Сравнение модели Михаэлиса-Ментен и положительной кооперации.
Различные модификаторы (ингибиторы или активаторы) изменяют скорости реакции. Например, при ингибировании — это может происходить посредством неконкурентного ингибирования, (неактивный комплекс образуется при взаимодействии ФСК с ингибитором), или посредством конкурентного ингибирования (тут фермент наряду с ФСК образует еще и неактивный комплекс с ингибитором).
1. Конкурентный тип ингибирования
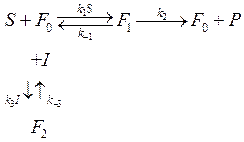 ,
,
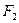 - неактивный комплекс, I - ингибитор
- неактивный комплекс, I - ингибитор
т.е. фермент дает и 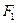 по одной цепи, и
по одной цепи, и 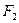 по другой
по другой
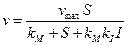 ;
; 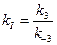 .
.
В случае конкурентного ингибирования 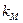 растет.
растет.
Рис.9. Зависимость 1/V от 1/[S] при конкурентном,
неконкурентном ингибировании и без ингибитора вовсе.
2. Неконкурентный тип ингибирования:
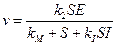 ;
; 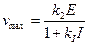 ,
,
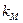 не меняется, т.к. такой ингибитор не мешает образованию ФСК (Рис.8.).
не меняется, т.к. такой ингибитор не мешает образованию ФСК (Рис.8.).
Ингибирование по типу отрицательной обратной связи схематически выглядит следующим образом:
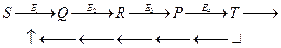
При исследовании ферментативных реакций был установлен "компенсационный эффект". Изменения энтальпии ∆H в процессах, протекающих в водных растворах, часто пропорциональны изменениям энтропии ∆S. То же относится и к активационным параметрам: 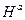 пропорционально
пропорционально  . Ламри предположил, что этот эффект определяется свойствами
. Ламри предположил, что этот эффект определяется свойствами 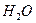 : изменение конформации белка, сопровождаемое вытеснением
: изменение конформации белка, сопровождаемое вытеснением 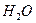 из активной полости глобулы, вызывает перестройку окружающей водной структуры.
из активной полости глобулы, вызывает перестройку окружающей водной структуры.
Активационные параметры ( 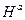 ,
,  ) сильно зависят от pH и ионного состава среды. При этом уравнение Аррениуса может не выполняться, т.к. глобула испытывает структурные перестройки, зависящие от T. И объяснение "компенсационного эффекта" может быть иным.
) сильно зависят от pH и ионного состава среды. При этом уравнение Аррениуса может не выполняться, т.к. глобула испытывает структурные перестройки, зависящие от T. И объяснение "компенсационного эффекта" может быть иным.
Зависимость ферментативной активности от pH определяется полиэлектролитной природой фермента.
Дата добавления: 2015-02-07; просмотров: 1429;
