Физика фермент-субстратного взаимодействия
1. Электростатические взаимодействия.
Физические особенности определяются белковой глобулой, которая по размерам больше субстрата. При сорбции S находится в полости с малой ε, т.е. там, где могут реализоваться сильные электростатические взаимодействия между реагентами и полярными группами фермента. Перутц считает, что это даёт главный вклад в энергетику ферментативного катализа, т.е. в понижение энергии активации. Отличие фермента от водного раствора состоит в том, что в активном центре АЦ фермента располагаются диполи с фиксированной ориентацией по отношению к заряженным группам субстрата, даже если поле этих зарядов мало. Вследствие такой ориентации ферменты могут стабилизировать пары ионов и другие распределения зарядов значительно лучше, чем H2O. В водных растворах электростатическое притяжение невелико, т.к. любая сила, создаваемая сближением противоположных зарядов, уравновешивается ориентацией диполей растворителя. В ферментах такая переориентация невозможна. Количественные расчёты на этой основе согласуются с экспериментом (снижение энергии активации для лизоцима).
2.При сорбции субстрата выделяется энергия. Предполагается, что она накапливается и идёт на упругие колебания глобулы, ведущей себя подобно капле жидкости. Частоты таких колебаний попадают в гиперзвуковую область и достигают 10-13 с-1. Энергия этих колебаний может активировать молекулу субстрата S. Расчёты показали, что энергия упругих колебаний глобулы может достигать 20-40 кДж/моль и обеспечивать значительное понижение эффективного активационного барьера. Но экспериментальных доказательств у гипотезы нет.
Стоячие волны в капле могут образовывать пучность в области активного центра и энергия упругих колебаний может активировать S. Но неясно, с какой скоростью энергия глобулы диссипирует в окружающую среду.
Оценим ускорение реакции при трансформации энергии сорбции в энергию ФСК. Для начала, предположим, что структурное соответствие фермент-субстрат в ФСК приводит и фермент, и субстрат в напряжённое состояние ("модель дыбы"). Пусть L0 — длина нерастянутой молекулы S, а L — длина полости фермента (Ф), в которую вошёл S. Изменения длины молекул S и Ф равны x и y. Тогда х + у=L - L0 и условие равенства упругих сил приобретёт вид:
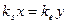
ks и ke — коэффициенты упругости S и Ф. Находим
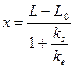 ;
; 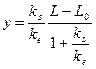 .
.
Упругая энергия субстрата, определяющая понижение энергии активации равна: 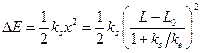 .
.
Порядок 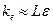 .
.
L — линейный размер глобулы, ε — модуль упругости глобулы. Для белка L ≈ 5 нм, е ≈ 103 Дж/см3 , значит ke ≈ 5∙10-2 Н/см.
Наибольшая энергия упругой деформации сосредотачивается в наиболее слабом месте молекулы S. Деформация валентных углов происходит легче, чем валентных связей. Вместе с тем, энергия, запасённая на угловых степенях свободы молекулы, может "перейти" на валентную связь и уменьшить энергию активации её разрыва. ks, отвечающий низкочастотным деформационным колебаниям (ν ≈ 1013 с-1), равен ≈ 0,15 Н/см. Допустим, что ∆Е = 31,5 кДж/моль (при уменьшении энергии активации на такую величину скорость реакции увеличивается в 105 раз). Тогда х ≈ 0,08 нм, у ≈ 0,23 нм, упругая энергия фермента
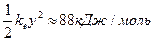 .
.
Значит, суммарная энергия расходуется при сорбции на упругую деформацию, составляет 171 кДж/моль. Это не столь высокая Е, если учесть что сорбция происходит за счёт многоточечного связывания, т.е. образования многих химических и слабых связей между Ф и S. Наблюдаемая энергия сорбции представляет собой разность истинной энергии сорбции и энергии упругой деформации Ф и S.
Модель "дыбы" — статическая. Если предположить, что упругая система является динамической и возникает резонанс колебаний молекул S и Ф, то для такого же ускорения реакции потребуется средняя упругая энергия в 4 раза меньше, чем в статическом случае, т.к. биения периодически удваивают амплитуду колебаний.
3.В таких процессах рассматриваются колебания атомных ядер, возникающих при образовании ФСК. При взаимодействии Ф с S изменяются состояния электронных оболочек субстрата и атомных групп активного центра. Электронные оболочки испытывают возмущение вследствие взаимодействий в ФСК. Превращение S в P (продукт) — это химический процесс, т.е. изменение состояния электронных оболочек молекул. При этом происходит перемещение атомных ядер, среди которых наименьшей энергии требуют низкочастотные деформационные колебания и повороты вокруг единичных связей, т.е. изменение конформаций. Для ферментативного катализа важнейшее значение имеют взаимодействия электронных и конформационных степеней свободы — ЭКВ.
Дата добавления: 2015-02-07; просмотров: 1056;
