Ферментативная активность лизоцима
Лизоцим — это фермент, разрушающий определённые бактериальные клетки (расщепляет полисахаридные цепи клеточной стенки, после чего клетка разрывается под действием осмотического шока — входа воды внутрь клетки).
Полисахарид клеточной стенки — полимер, в котором чередуются остатки сахаров двух типов — N-ацетилглюкозамин (NAG) и N-ацетилмурамовая кислота (NAM). Сахара, имеющие β-конфигурацию относительно С1-атома, образуют полимерную цепь с помощью гликозидных связей между С1- одного сахарного кольца и С4-атомом следующего.
Структура лизоцима. Лизоцим (из белка куриного яйца) состоит из одной полипептидной цепи, насчитывающей 129 остатков и имеющей 4 дисульфидных мостика. Фермент может связываться с ингибиторами, химически сходными с полисахаридом клеточной стенки. С помощью рентгеноструктурного анализа Филипсом и др. была определена пространственная структура белка как такового и белка, закристаллизованного вместе с ингибитором. Оказалось, что лизоцим состоит из двух доменов (α и β-типов), образующих щель, в которой находится активный центр, способный связать гексосахарид, причём, для связывания каждого из шести сахарных колец на ферменте имеется свой участок (это участки A, B, C, D, E, F).
Расщепление полисахарида осуществляется путём гидролиза гликозидной связи между сахарными кольцами, располагающимися в участках D и E. Анализ кристаллографических данных позволил предположить, что непосредственно перед и после гидролиза сахарное кольцо в участке D имеет не обычную конформацию кресла, а конформацию полукресла, характеризующуюся тем, что 5 из 6 атомов, образующих сахарное кольцо, лежат практически в одной плоскости. Центральную роль в функционировании лизоцима играют остатки глутаминовой кислоты Glu35 и аспарагиновой кислоты Asp 52. Боковые цепи этих остатков располагаются близко к гликозидной связи (~ 0.3 нм) между сахарными кольцами, локализованными в участках D и E. Glu 35 находится в неполярном окружении, и поэтому его карбоксильная группа остаётся протонированной (т.е. в форме СООН). Окружение Asp 52, наоборот, полярно и эта группа депротонирована (–СОО- ).
Реакцию гидролиза можно подразделить на несколько этапов:
1.–СООН-группа Glu 35 предоставляет свой протон гликозидному кислороду, что приводит к разрыву связи между этим атомом кислорода и С1-атомом сахарного кольца, располагающегося в участке D. Получившийся в результате фрагмент исходного полисахарида, включающий в себя сахарные кольца, которые находятся в участках E и F, является продуктом и может освободиться из комплекса с ферментом.
2.Сахарное кольцо, располагающееся в D–участке, имеет искажённую конформацию, соответствующую конформации переходного состояния. При этом С1-атом оказывается положительно заряженным. Такое состояние углеродного атома называется карбоний-ионом. Оно стабилизируется с помощью отрицательного заряда близко расположенного остатка Asp 52.
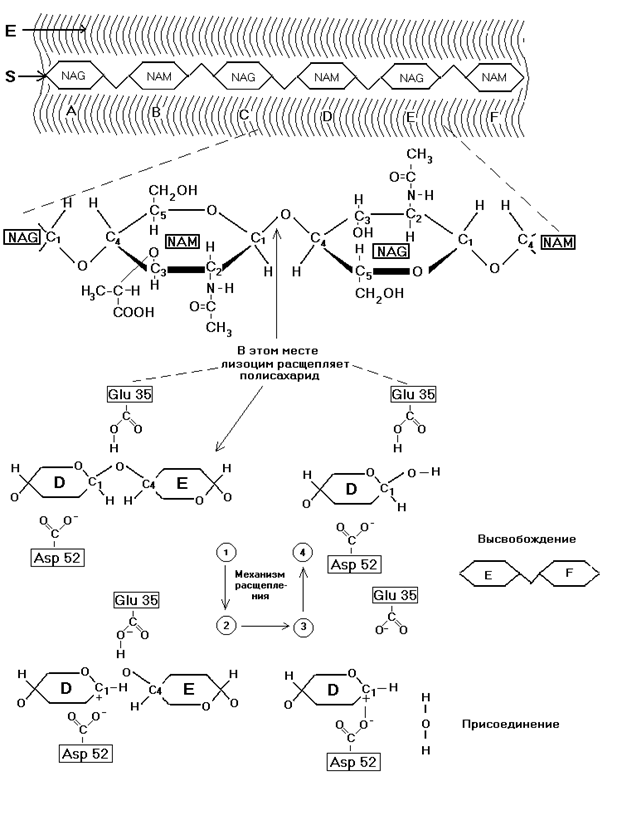
Рис.15.Связывание сахаров с лизоцимом стабилизируется при помощи гидрофобных взаимодействий и водородных связей.
3.Гидроксильный ион ОН-, донором которого является Н2О из окружающей среды, присоединяется к карбоний-иону, после чего второй фрагмент расщепленного полисахарида становится продуктом реакции. Одновременно из-за связывания иона водорода (Н+) протонируется карбоксильная группа Glu 35, переходя в форму –СООН.
4.Теперь фермент находится в первоначальном состоянии и готов осуществить следующую реакцию расщепления полисахарида.
Этот пример позволяет проследить некоторые общие принципы ферментативного катализа.
1.Увеличение энергии субстрата за счёт искажения структуры сахарного кольца NAM, находящегося в D-участке.
2.Наличие необычного окружения Glu 35, обусловливающее появление реакционноспособного протона.
3.Правильная ориентация протона в Glu 35, необходимая для атаки гликозидной связи.
4.Уменьшение свободной энергии переходного состояния за счёт стабилизации карбоний-иона карбоксильной группой остатка Asp52.
Дата добавления: 2015-02-07; просмотров: 1771;
