Химические аспекты действия ферментов
Особенности ферментативного катализа — большая активность и строгая специфичность по отношению к субстрату.
Молекулярной активностью фермента (или числом оборотов) называется число молей субстрата, превращаемых в одну минуту одним молем фермента при значительном избытке субстрата S>>E (Многие ферменты получены в кристаллической форме и изучаются in vitro)
Активный центр полифункционален: способен связывать субстрат и проявляет каталитическую активность, причем сорбция предшествует катализу; разрываются старые связи и образуются новые.
Ферментативная реакция многостадийна (идёт через ряд химических превращений).
Пример креатинкиназы, катализирующей реакцию:
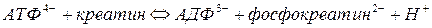 .
.
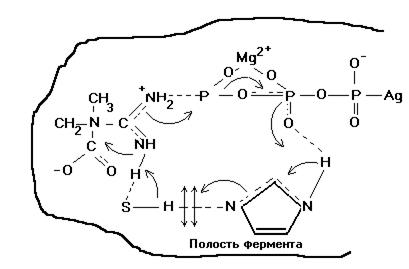
Рис.10. Схема действия креатинкиназы.
На рисунке изображена схема переходного состояния для этой реакции.  — кофактор. Важна роль SH группы в активном центре.
— кофактор. Важна роль SH группы в активном центре.
Фермент инактивируется йодацетамидом и йодацетатом. В присутствии  и обоих субстратов (креатина и ATP) SH группа защищена от действия блокирующих агентов. Очевидно, SH группа соединена H-связью с одной из основных групп фермента. Благодаря лёгкому переходу протона в системе кислота-основание, соединённых H-связью, такая система обладает высокой каталитической активностью. (Стрелки показывают сдвиги электронов в субстратах и группах активного центра).
и обоих субстратов (креатина и ATP) SH группа защищена от действия блокирующих агентов. Очевидно, SH группа соединена H-связью с одной из основных групп фермента. Благодаря лёгкому переходу протона в системе кислота-основание, соединённых H-связью, такая система обладает высокой каталитической активностью. (Стрелки показывают сдвиги электронов в субстратах и группах активного центра).
При образовании ФСК существенна точная взаимная ориентация функциональных групп фермента и субстрата или модификатора. Активный центр хирален и стереоспецифичен.
Пример: превращение аминомалоновой кислоты в глицин.
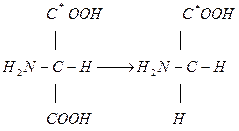 ;
;
* — радиоактивная метка.
Реакции таких молекул происходят на поверхности фермента асимметрично.
В реакцию вступает только одна группа COOH. Это объясняется асимметрией активного центра Т.к. группы фермента, связывающиеся с COOH, различны, то различны и реакции.
Ферменты хорошо различают стереоизомеры, и оптический антипод данного субстрата субстратом уже не является.
Для ряда ферментов подробно изучена последовательность химических превращений в активном центре ФСК.
Пример: химия аспартат-аминотрансферазы (ААТ).
Этот фермент содержит пиридоксальфосфат (ПАЛФ) в качестве кофермента. ПАЛФ, присоединённый к белку, реагирует с субстратом — аминокислотой, химически образуя альдимин (шиффово основание):
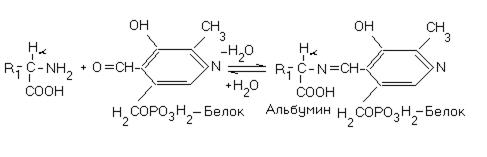
Рис.11. Атом  легко диссоциирует в альдимине.
легко диссоциирует в альдимине.
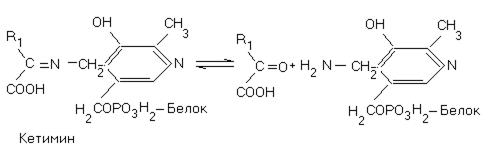
Рис 12. При реакциях переаминирования альдимин таутомеризуется в кетимин, который гидролизуется водой с образованием кетокислоты.
Возникает пиридоксаминная форма фермента, реагирующая с другой кетокислотой, содержащей 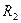 вместо
вместо 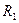 , причём регенерируется исходный фермент и получается новая аминокислота
, причём регенерируется исходный фермент и получается новая аминокислота 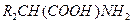 . Такова схема реакции трансаминирования — переноса аминогруппы.
. Такова схема реакции трансаминирования — переноса аминогруппы.
Практически все реакции могут протекать без фермента, но с малой скоростью.
Эти примеры показаны, чтобы проиллюстрировать возможности расшифровки взаимодействий активного центра фермента и лиганда (субстрата).
Химия выявляет поведение функциональных групп фермента и кофакторов. Но этого недостаточно для количественного объяснения ферментативной активности, характеризуемой понижением энергии активации. Для ферментативного катализа нужна вся белковая глобула. Нельзя отрезать часть белковой цепи без нарушения активности фермента. Химия не говорит о роли глобулярной структуры. Это задача физики.
Суммируя результаты химических исследований ферментов, Браунштейн указал на факторы, ответственные за их действие:
1. Большое сродство фермента к субстрату, т.е. большая вероятность образования ФСК, что эквивалентно резкому увеличению концентрации реагентов (эффект сближения).
2. Строгая взаимная ориентация реагентов (S), кофакторов и активного центра (эффект ориентации).
3. Воздействие на субстрат нуклеофильных и электрофильных групп активного центра(эффект синхронного кислотно-основного катализа). Кооперация кислотных и основных групп, их совместное действие резко ускоряют реакцию
4. Активация субстрата путём перераспределения электронной плотности под действием активных групп фермента (эффект поляризации)
5. Изменение конформации белка и субстрата в ФСК (эффект индуцированного контакта).
Отношение скорости ферментативного процесса по отношению к скорости неферментативного для ряда ферментов (лизоцим, химотрипсин, β-амилаза, фумараза) составлет ~ 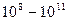 .
.
Дата добавления: 2015-02-07; просмотров: 1426;
