Строение толстых и тонких нитей мышечного волокна
Элементарной структурной единицей толстых нитей саркомера является молекула миозина. Миозин скелетных мышц (миозин класса II) является довольно крупным белком, состоящим из шести полипептидных цепей. Эта молекула представляет собой димер, образованный из двух сплетенных друг с другом одинаковых мономеров миозина (рис. 2,а). Каждый из этих мономеров состоит из одной тяжелой цепи (молекулярная масса 230 кДа) и двух легких цепей (молекулярная масса 20 кДа). Тяжелая цепь миозина неоднородна по своему строению. На одном конце ее полипептидная цепь свернута в виде глобулы, образующей своеобразную "головку" миозина (фрагмент S1). С помощью более тонкой шейки (фрагмент S2) головка миозина соединяется с длинным хвостом, который образован протяженной полипептидной цепью, уложенной в виде вытянутой a-спирали. Хвосты двух мономерных единиц миозина сплетены друг с другом и образуют вытянутый стержень длиной 170 нм и толщиной 2 нм. Две подвижные головки, выступающие вбок из этого стержня (рис. 2,а), выполняют моторные функции - в ходе работы сократительного аппарата наклон головок миозина относительно его хвоста изменяется, в результате чего обеспечивается взаимодействие миозина с актином.
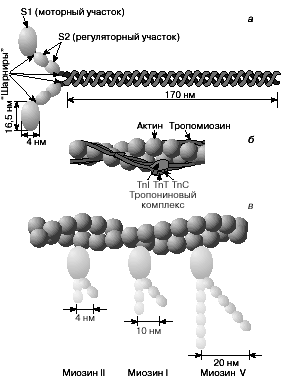
Рис. 2. Строение молекулы миозина (а) и тонкой нити (б). В расслабленной мышце тропомиозин препятствует взаимодействию головки миозина с актином. Внизу (в) схематически показано различие геометрических характеристик моторных участков молекул миозина трех разных типов.
Моторный фрагмент миозина (S1) непосредственно взаимодействует с тонкой актиновой нитью. Фрагмент S1 включает в себя каталитический центр, с которым связывается молекула АТР и где происходит ее гидролиз до ADP и Pi . В ходе реакции гидролиза АТР выделяется энергия, за счет которой работает миозин. В 1993 году Айвэн Рэймент и его коллеги методом рентгеноструктурного анализа установили пространственное строение головки миозина. Согласно их данным, фрагмент S1 представляет собой глобулу размером 16,5 x 6,5 x 4 нм. На картине трехмерного строения S1, полученной с разрешением 2,8 Å, четко видны оба функционально важных участка: место посадки АТР и выступающий наружу участок полипептидной цепи, который непосредственно взаимодействует с актином. Вращательная подвижность головки миозина обеспечивается за счет шарниров, которые представляют собой гибкие участки полипептидной цепи. Один из них находится в месте соединения фрагментов S1 и S2, другой расположен между фрагментом S2 и хвостом миозина (рис. 2,а). Наличие молекулярных шарниров дает возможность фрагменту S1 присоединяться и отсоединяться от нити актина, а также изменять свою ориентацию в ходе сократительного цикла (рис. 3, 4).
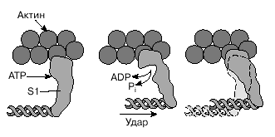
Рис. 3. Схема, показывающая изменение положения головки миозина (S1) относительно тонкой нити в ходе структурных перестроек актомиозинового комплекса, которые приводят к возникновению силы, тянущей хвост миозина.
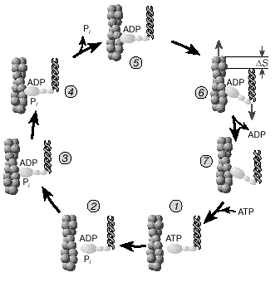
Рис. 4. Цикл структурных превращений актомиозинового комплекса, приводящих к смещению молекулы миозина вдоль нити актина.
Функционально важным звеном молекулы миозина является ее регуляторный участок, расположенный в области шейки, соединяющей каталитическую головку с хвостом молекулы миозина. Шейка образована альфа-спиралью полипептидной цепи длиной 8-9 нм, которая окружена двумя легкими полипептидными цепями S2. Шейка, по сути дела, является рычагом, через который структурные изменения в каталитическом центре передаются хвостовой части молекулы миозина. Легкие цепи придают этому рычагу необходимую жесткость и выполняют важную роль в регуляции каталитической активности миозина.
Молекулы миозина в мышцах работают не поодиночке, а образуют сравнительно толстые жгуты из сплетенных друг с другом димеров. В саркомерах поперечнополосатых мышц каждая толстая нить состоит приблизительно из 300 сплетенных димеров миозина. С обоих концов толстой нити выступают многочисленные подвижные мостики, которые могут связываться с окружающими их тонкими нитями актина (рис. 1,б).
Тонкие нити мышечных волокон состоят из нескольких белков (рис. 2,б). Основной составляющей тонких нитей является актин, присутствующий в них в форме вытянутых полимерных нитей. Эти нити образованы из мономеров глобулярного белка (G-актин), имеющего молекулярную массу 42 кДа. В растворе мономеры G-актина могут связываться друг с другом, образуя вытянутые линейные полимеры (F-актин) диаметром 6-7 нм, называемые микрофиламентами. Тонкие нити сократительного аппарата мышц, с которыми взаимодействуют миозиновые мостики, наряду с актином содержат также другие белки - тропомиозин и три белка тропонинового комплекса (рис. 2,б), которые играют решающую роль в регуляции взаимодействия миозина с актином. По своей массе они составляют приблизительно треть от всей массы тонких нитей. Молекула тропомиозина состоит из двух вытянутых альфа-спиралей длиной около 38 нм, инкрустированных в гораздо более протяженную нить F-актина. Тропониновый комплекс состоит из трех белков (TnC, TnI и TnT). Белок TnI непосредственно связан с актином, а белок TnT - с тропомиозином. Белок TnC принадлежит к классу регуляторных белков, называемых кальмодулинами. Этот белок активируется при его взаимодействии с ионами Ca2+. Тропониновые комплексы расположены вдоль тонкой нити через регулярные интервалы, длина которых составляет 38,5 нм, что соответствует длине молекулы тропомиозина.
Дата добавления: 2015-02-07; просмотров: 1460;
