Электрофоретическая подвижность
Подвижность белка в изоэлектрической точке равна нулю. При сдвиге рН на две единицы в любую сторону, подвижность белка становится сравнима с подвижностью малых ионов. Она зависит также от ионной силы и температуры, поэтому о подвижности следует говорить, когда хорошо известны условия среды. Основной причиной различий подвижности является белковый заряд. Но нельзя все сводить только к заряду. Согласно теории Дебая-Хюккеля в растворе электролита каждый заряд экранирован диффузной атмосферой противоионов, плотность которой убывает с расстоянием по закону:
ρ = ρ0е-ær ,
r – расстояние,
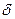 =1/æ – средняя толщина ионной атмосферы.
=1/æ – средняя толщина ионной атмосферы.
æ = 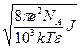 ,
,
J = 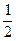
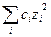 – ионная сила, е – заряд электрона,
– ионная сила, е – заряд электрона, 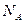 − число Авогадро,
− число Авогадро, 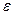 − диэлектрическая проницаемость.
− диэлектрическая проницаемость.
Подвижность сферических частиц, движущихся при электрофорезе, с точностью до коэффициента определяется формулой Смолуховского:
U = 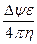 ,
,
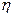 - это вязкость среды,
- это вязкость среды, 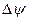 - разность потенциала в двойном слое, окружающем частицу.
- разность потенциала в двойном слое, окружающем частицу.
Рассмотрим два случая:
1) низкие ионные силы (разбавленный раствор электролита): J << 0,01.
В этих растворах толщина дебаевской диффузной оболочки больше размеров частиц. При таких условиях:
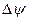 =
= 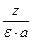 , где z - заряд белковой частицы,
, где z - заряд белковой частицы, 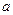 – ее радиус.
– ее радиус.
Заряд глобулы пропорционален её поверхности:
z = 4πa2αe , где αе – заряд единицы поверхности. Тогда электрофоретическая подвижность:
U = 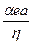 .
.
2) ионная сила J 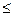 0,1.
0,1.
Толщина ионной атмосферы 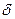 <10 Å (т. е. меньше размера белковой глобулы
<10 Å (т. е. меньше размера белковой глобулы 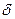 <
< 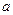 ). Скачок потенциала
). Скачок потенциала 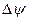 сосредоточен полностью в слое
сосредоточен полностью в слое 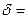 1/æ. В этих условиях:
1/æ. В этих условиях:
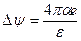 æ-1
æ-1 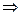 U =
U = 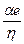 æ-1.
æ-1.
В этом случае подвижность не зависит от размера частицы, от молекулярной массы белка. Это ближе к реальным условиям электрофореза белков, который при не слишком низких ионных силах буферных растворов определяется зарядом, но не сильно чувствителен к молекулярным массам и размерам белков.
Дата добавления: 2015-02-07; просмотров: 1330;
