Хронические нарушения нейрорегуляции обмена веществ
Регуляция калорического гомеостаза, определяющего сохранение массы тела, является в основном функцией вентромедиального и вентролатерального гипоталамуса, хотя значительная роль принадлежит и посылкам из внегипоталамических структур, в особенности из лимбической системы и конечного мозга. Опыты со стимуляцией и повреждением отдельных участков гипоталамуса у животных позволили надежно установить локализацию центра насыщения в вентромедиальной области и пищевого центра в вентролатеральной области, хотя по вопросу о том, что играет основную роль: тела специфических нейронов в ядре или аксоны, проходящие через эту область, — все еще имеются разногласия. Сигналы, активирующие формы поведения, характерные для чувства голода и насыщения, также неизвестны. Прежняя гипотеза о роли глюкозы в опосредовании этих сигналов в настоящее время оставлена и, по современным представлениям, большее значение имеет сигнал, отражающий периферические запасы жира в организме, хотя точную природу его еще предстоит выяснить. Присутствие как инсулина, так и его рецепторов в ЦНС делает возможным участие этого гормона в опосредовании такой связи, но убедительные доказательства пока отсутствуют. Механизм развития ожирения сложен, и в нем принимают участие повышенное потребление пищи, сниженная физическая активность и опосредуемые автономной нервной системой влияния на поджелудочную железу, печень, мозговой слой надпочечников и жировую ткань. Подробный анализ регуляции потребления пищи и роли гипоталамуса в регуляции обмена веществ приведен в одной из последующих глав, а также в недавно опубликованных обзорах [3, 57].
Разрушение вентромедиального гипоталамуса обусловливает развитие синдрома ожирения, тогда как повреждение вентролатерального гипоталамуса приводит к анорексии и исхуданию. Последнее встречается реже, так как для этого требуется двустороннее повреждение, а возникающая одновременно утрата других важных гомеостатических механизмов обычно делает эту патологию несовместимой с длительным выживанием.
Лишь у небольшого процента больных чрезмерное ожирение или истощение можно отнести на счет определенных анатомических дефектов гипоталамуса. Однако невозможность разграничения клинических и биохимических проявлений ожирения или истощения у больных с патологией гипоталамуса и без нее подтверждает гипотезу, согласно которой «функциональные» расстройства калорического баланса (т. е. «эссенциальное» ожирение и/или нервная анорексия) определяются какими-то пока не выясненными нарушениями функции гипоталамуса.
Гипоталамическое ожирение. Разрушение вентромедиального гипоталамуса развивающейся опухолью, при травме, сосудистых кризах, псевдоопухолью головного мозга, при энцефалите или инфильтративных заболеваниях (лейкоз или гистиоцитоз X) сопровождается ожирением [58]. Гиперфагия и увеличение массы тела продолжаются до тех пор, пока не уменьшается время потребления пищи. Хотя некоторые авторы обращают внимание на тенденцию к накоплению жира в центральных частях тела при гипоталамическом ожирении, то же самое можно наблюдать у лиц с выраженным ожирением при отсутствии определяемой патологии гипоталамуса. Предполагается, что при гипоталамическом ожирении гиперинсулинемия более выражена, чем при других формах тучности [58], но число обследованных больных слишком мало, чтобы можно было сделать окончательный вывод. Между больными с гипоталамическим и «эссенциальным» ожирением не найдено различий в отношении потребления кислорода соотношение жиров, белков и углеводов в организме или метаболизма жировой ткани. Увеличение массы жировой ткани при гипоталамическом ожирении обусловлено в основном гипертрофией, а не гиперплазией адипоцитов. Обычно весьма выражена инсулинорезистентность, и у некоторых больных диагностирован диабет. Секреция СТГ всегда нарушается, как и при других формах ожирения. Изменения функции половых желез и полового поведения, колеблющиеся от бесплодия или снижения либидо до истинного гипогонадизма, при тяжелом ожирении весьма распространены. У некоторых больных эти изменения, по-видимому, вторичны, так как исчезают после уменьшения массы тела, но у других они сохраняются и обусловлены, вероятно, одновременным поражением участков гипоталамуса, контролирующих секрецию ЛГ-РГ.
Некоторые хорошо известные синдромы, сопровождающиеся ожирением, подтверждают представление о первичном гипоталамическом генезе его (табл. 8—2). Многие из них отличаются се-
Таблица 8—2. Синдромы, сопровождающиеся гипоталамическим ожирением
| Синдром | Клинические проявления | Этиология |
| Бабинского—Фрелиха | Ожирение и гипогонадизм | Краниофарингиома или другая опухоль, распространяющаяся на вентромедиальный гипоталамус и срединное возвышение |
| Клейне — Левина | Эпизодическая гиперосмия, гиперфагия, гиперактивность в бодрствующем состоянии, гиперсексуальность | У некоторых больных предшествующая вирусная инфекция. Заболевание наблюдается главным образом у мальчиков-подростков. В возрасте старше 20 лет обычно исчезает. Гистологические исследования не проводились. Возможное пароксизмальное поражение лимбической системы или гипоталамуса |
| Лоренса — Муна | Пигментная дегенерация сетчатки, умственная отсталость, спастическая параплегия, гипогонадизм, ожирение | Аутосомно-доминантное наследование; не наблюдалось ни макро-, ни микроскопических повреждений гипоталамуса |
| .Барде — Бидля | Пигментная ретинопатия, умственная отсталость, полидактилия, гипогонадизм, ожирение | Анатомических повреждений не наблюдалось |
| -Альстрема — Хальгрена | Пигментная ретинопатия, гипогонадизм, глухота, ожирение, диабет | Анатомические повреждения не наблюдались |
| -Эдвардса и др. | Пигментная ретинопатия, гипогонадизм, гинекомастия, умственная отсталость, глухота, ожирение, диабет | Аутосомно-рецессивное наследование. Гистологические исследования не проводились |
| Прадера — Вилли | Гипогонадизм, диабет, низкорослость, ожирение, нарушение толерантности к температурным воздействиям, утрата суточных ритмов | Анатомические повреждения не наблюдались |
Источники: адаптировано из публикации McKusick [59], Edwards и соавт. [60]. Plum, Van Uitert [i]. мейным распространением, хотя способ наследования может варьировать. Они сопровождаются признаками и других гипоталамических нарушений (гипогонадизм, нарушение толерантности к температурным воздействиям, утрата суточных ритмов), кроме того, наблюдаются и внегипоталамические нарушения (глухота, пигментная ретинопатия, задержка умственного развития). Специфические патологические механизмы ожирения при большинстве из этих синдромов неизвестны. Однако генетическое изменение чувствительности хеморецепторных клеток в гипоталамусе могло бы приводить к изменению сигналов насыщения или голода и нарушениям функции автономной нервной системы обусловливающим повышение липогенеза.
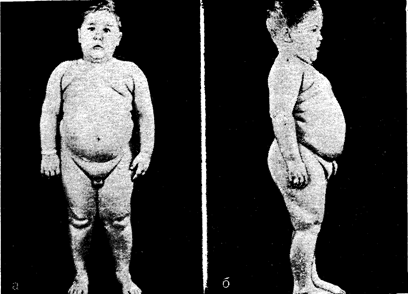
Рис. 8—1. Мальчик в возрасте 3 лет с гиперфагическим ожирением вследствие острой лимфоцитарной инфильтрации гипоталамуса. Введение в спинномозговой канал метотрексата вызвало ремиссию со снижением аппетита и потерей почти всего избытка жировой ткани. В период последующего рецидива гиперфагия и ожирение возобновились.
Лечение гипоталамического ожирения в большинстве случаев оказывается безуспешным. У детей с нейролейкемией и гипоталамическими инфильтратами (рис. 8—1) ремиссия основного заболевания под действием химиотерапевтических средств приводит к исчезновению гиперфагии и нормализации массы тела, что свидетельствует об интактности наиболее важных в этом отношении гипоталамических структур. Однако после истинного разрушения отдельных зон гипоталамуса функциональные нарушения становятся необратимыми. Терапевтические мероприятия при патологическом ожирении, описанные в одной из последних глав, составляют в настоящее время единственную альтернативу.
Диэнцефальный синдром у детей. Описано приблизительно 70 детей с синдромом истощения и гиперкинезии, у которых иногда отмечается большой размер кистей и стоп; синдром связан с инвазирующими опухолями (обычно глиомы), исходящими из перекрестка зрительных нервов или переднего гипоталамуса и остающимися к моменту появления симптомов в пределах передней и туберальной области [61]. Многие дети оживлены и веселы, тогда как другие могут быть раздражительными, они сохраняют хороший аппетит и имеют нормальный рост. Лишь очень немногие больные подвергались достаточному эндокринно-метаболическому обследованию, хотя у некоторых отмечалось отсутствие циркадных колебаний уровня кортизола в плазме, отсутствие реакции на метопирон и повышение уровня СТГ наряду с парадоксальными реакциями его на гипер- и гипогликемию. Большинство детей умирают в течение первых 2 лет вследствие истощения и сопровождающих его осложнений.
У нескольких детей, переживших 2-летний возраст, болезнь часто претерпевает резкую трансформацию. Аппетит увеличивается, истощение исчезает и дети становятся крайне тучными [62]. На смену прежней эйфории и гиперактивности обычно приходит раздражительность и даже приступы ярости. Прогноз для жизни становится более благоприятным, но неизвестно, связано это с изменением метаболизма или с особенностями роста опухоли [63].
Неясно, почему разрушение незрелого гипоталамуса вызывает симптомы, отличающиеся от таковых у детей более старшего возраста и у взрослых. Однако имеются экспериментальные данные, указывающие на то, что функция вентромедиального ядра, контролирующего потребление пищи, до прекращения грудного вскармливания не играет существенной роли. В связи с этим повреждение нефункционирующего вентромедиального гипоталамуса могло бы вызывать сравнительно скудную симптоматику, а преобладать должны были бы эффекты гипофункции вентролатерального отдела. По мере созревания отсутствие вентромедиального гипоталамуса должно было бы приобретать все большее клиническое значение и ведущим симптомом должно было бы становиться ожирение.
Нервная анорексия. Нервная анорексия известна уже более 300 лет как заболевание, проявляющееся преимущественно уменьшением массы тела, аменореей и поведенческими нарушениями, наблюдаемыми почти исключительно у молодых женщин. Его считают результатом психических, эндокринно-метаболических нарушений или сочетания того и другого [64]. В прошлом этот диагноз ставился очень широко многим женщинам с аменореей и исхуданием, что порождало значительные трудности в оценке истинных клинических особенностей заболевания и эффективности его лечения. В настоящее время большинство врачей считают, что при постановке диагноза необходимо учитывать и отклонения в психике. Болезнь характеризуется рядом существенных особенностей.
1. Заболевание начинается в возрасте моложе 25 лет, чаще всего в интервале между 14 и 19 годами. Оно может встречаться и у юношей, по это наблюдается крайне редко (менее чем в 5% случаев).
2. Диагноз оправдан лишь при значительном уменьшении массы тела (не менее 25% от исходной).
3. У больных искажается отношение к еде и возникает неправильное представление об идеальной массе тела, что заставляет их терпеть голод, не поддаваясь на увещевания и угрозы. Больные отрицают факт заболевания и не осознают своих пищевых потребностей. Они как бы получают удовольствие от исхудания и отказываются принимать пищу. Они считают красивой крайнюю худобу и уделяют особое внимание хранению или обработке пищи. Истинная анорексия проявляется лишь в поздние стадии заболевания. Наиболее тяжелыми нарушениями пищевого поведения, наблюдающимися у 50% больных, являются булемия (избыточное потребление пищи) и рвота. Для больных этой группы особенно характерны гипогликемия и аритмии.
4. Практически у всех больных женщин наступает аменорея, и у 25% больных она предшествует значительному уменьшению массы тела.
5. Для диагноза крайне важно исключить другие соматические и психические заболевания. К дополнительным признакам относятся брадикардия, гипотензия, гипотермия, запоры, нарушение терморегуляции, оволосение, гиперкаротинемия, обусловливающая желтизну ладонных поверхностей кисти, иногда нерезко выраженный несахарный диабет и в тяжелых случаях отек нижних частей тела.
Для определения характера эндокринных нарушений у больных с нервной анорексией были проведены многочисленные исследования. Аменорея связана со снижением уровня эстрадиола, прогестерона, ЛГ и ФСГ, а у зрелых женщин утрачивается пульсирующий характер секреции ЛГ (рис. 8—2). Такая «регрессия» секреции ЛГ в направлении к наблюдаемой в раннем препубертатном периоде весьма характерна для этого заболевания. Реакцию гонадотропинов на ЛГ-РГ и даже овуляцию можно восстановить путем ежедневных инфузий ЛГ-РГ, что указывает на снижение секреции эндогенного рилизинг-гормона.
Уровень СТГ остается в пределах нормы или иногда повышен, особенно при тяжелом нарушении питания, причем часто наблюдается парадоксальное повышение его в ответ на введение глюкозы. У некоторых больных секреция СТГ стимулируется ТРГ. Уровень ТТГ также сохраняется в пределах нормы, хотя его реакция на ТРГ часто запаздывает. Содержание Т4 обычно не изменяется, но концентрация Т3 нередко снижена, а реверсивного Тд — повышена. Уровень кортизола в плазме, как правило, повышен, а суточные колебания его у 50% больных отсутствуют. Реакция на инсулиновую гипогликемию, однако, сохраняется. Экскреция 17-КС снижается, что отражает низкую секрецию дегидроэпиандростерона и сульфата дегидроэпиандростерона. Нарушения секреции пролактина не описаны.
У больных с нервной анорексией при резком охлаждении или перегревании не возникает дрожи или других реакций, направлен-
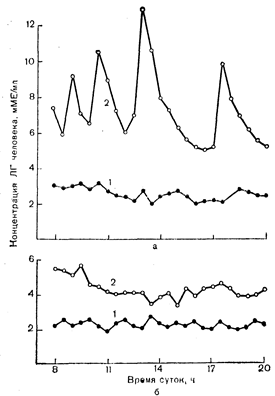
Рис. 8—2. Прекращение эпизодической секреции ЛГ при «нервной» анорексии. У больной при первом исследовании (а) в период, когда ее масса тела была на 26% меньше исходной (1), отсутствовали «вспышки» секреции Л Г. После восстановления массы тела до уровня, всего на 8% меньше исходного (2), эпизодическая секреция ЛГ возобновилась. У 1/3 больных (б) отсутствие эпизодической секреции ЛГ и аменорея сохраняются, несмотря на то же (1) или даже большее (2) восстановление массы тела (Frohman L. A., Casper L., неопубликованные наблюдения). ных на сохранение исходной температуры тела. У 1/3 больных нарушается способность концентрировать мочу при ограничении приема жидкости, что восстанавливается при введении АДГ и указывает тем самым на частичный несахарный диабет.
Нарушения секреции гонадотропинов, запаздывающая реакция ТТГ на ТРГ и изменения секреции СТГ и кортизола свидетельствуют о гипоталамическом дефекте. Нормализация секреции гормонов гипофиза после успешного лечения заболевания подтверждает представление о том, что нарушения в области гипоталамуса является вторичным по отношению к уменьшению массы тела. Однако сохранение аменореи у многих даже после полной нормализации массы тела и нарушения реакции Л Г плазмы на стимуляцию кломифеном указывают на роль еще какого-то фактора, помимо недостаточности питания [65].
Вопросы лечения нервной анорексии во многом выходят за рамки задач этой главы и недавно подробно рассматривались в другой работе [64]. Основной подход заключается в восстановлении адекватного питания наряду с соответствующими психотерапевтическими мероприятиями. Во многих случаях эффективной оказывалось соблюдение диеты (жидкая пища, в начале лечения содержащая 1200—1500 ккал в день с увеличением через неделю до 3000 ккал в день). Следует настаивать на приеме твердой пищи для обеспечения полноценности диеты. Пробовали применять многие психофармакологические средства (например, ципрогептадин, нейролептики, L-ДОФА, антидепрессанты), но ограниченная эффективность и значительные побочные эффекты, по-видимому, не оправдывают их использования.
В настоящее время прогноз в отношении ликвидации кахексии и кратковременного увеличения массы тела более благоприятен, чем был в прошлом. Смертность от последствий голодания (обычно из-за снижения сопротивляемости к инфекции) составляет 5% или меньше [65]. У большинства больных удается восстановить массу тела не менее чем до 90% от исходной, однако примерно лишь у 40% больных масса тела сохраняется постоянной и нормализуются овуляторные циклы. Еще у 25% больных поддержание массы тела сопряжено с меньшими трудностями, но у них очень часто сохраняется аменорея. В том же проценте случаев происходит рецидив исхудания, появляются симптомы тяжелой депрессии и сохраняется аменорея.
Дата добавления: 2015-01-19; просмотров: 1298;
