СУДЬБА ГОРМОНРЕЦЕПТОРНОГО КОМПЛЕКСА
Большинство исследований, посвященных механизму действия пептидных гормонов, сосредоточено на острых реакциях, развивающихся вслед за связыванием гормона с его рецептором на клеточной поверхности. Меньше известно о механизмах столь же важных отдаленных влияний на рост и дифференцировку клеток или о способах прекращения действия гормональных стимулов. Эти процессы могут иметь отношение к судьбе гормонрецепторного комплекса. Как уже отмечалось, есть указания на то, что первоначальное обратимое взаимодействие сменяется состоянием более высокого сродства, обусловливающим сохранение недиссоциирующего комплекса в течение длительного периода времени. Эти данные наряду с накапливающимися сведениями о присутствии гормонов и мест их связывания внутри клеток-мишеней позволяют думать о том, что частым следствием гормонрецепторного взаимодействия является интернализация. Интерес к этому процессу стимулировали данные о поглощении и кругообороте холинергических рецепторов и комплексов липопротеинов низкой плотности (ЛПНП) со своими рецепторами [23]. В силу этого все большее значение стали придавать интернализации и в судьбе гормонрецепторных комплексов в тканях-мишенях. Механизм процесса интернализации по отношению к пептидным гормонам имеет, вероятно, много общих черт с процессами модуляции поверхности лимфоцитов и образования системы «окаймленных ямок», обусловливающей поглощение макромолекул, таких, как ЛПНП (рис. 4—8). Основа увеличения числа рецепторов в клетках-мишенях, вызываемого такими пептидами, как ангиотензин II и пролактин, требует дальнейшего изучения, но, по всей вероятности, этот процесс вначале связан с изменением конформации мембраны, а позднее с увеличением синтеза рецепторов. Для некоторых гормонов, таких, как ангиотензин II, действующий на клубочковую зону коры надпочечников, позднее увеличение числа рецепторов могло бы являться частью общей клеточной реакции на действие тропного гормона.
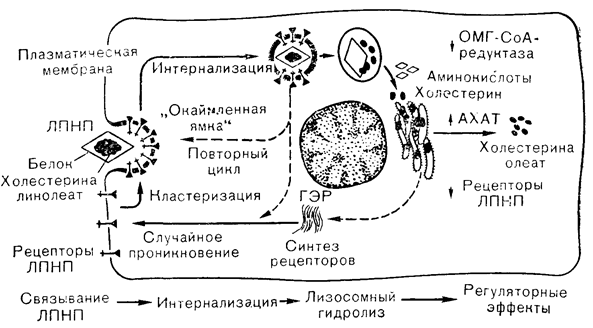
Рис. 4—8. Способ поглощения липопротеинов низкой плотности (ЛПНП) культивируемыми фибробластами. Считают, что рецепторы ЛПНП, синтезируемые на полирибосомах, в случайном порядке проникают в клеточную мембрану и непрерывно подвергаются кластеризации в «окаймленных ямках», сменяемой интернализацией в составе эндоцитозных пузырьков. После отложения ЛПНП в лизосомах рецепторы, по-видимому, используются в новом цикле, возвращаясь на клеточную поверхность, где они вновь подвергаются кластеризации в «окаймленных ямках». Поступающий холестерин подавляет образование микросомального фермента (ОМГ-СоА-редуктазы), который лимитирует скорость биосинтеза холестерина, стимулирует фермент, ответственный за синтез эфиров холестерина и угнетает синтез рецепторов ЛПНП (Brown, Goldstein [23] в модификации). ГЭР — гладкий эндоплазматический ретикулум.
Результаты ряда исследований указывают на роль цитоплазматических сократительных элементов в мобильности и регуляции рецепторов. В лимфоидных клетках лигандрецепторное взаимодействие сменяется образованием рецепторных «пятен», их агрегацией в несколько более крупные «пятна» или одну «нашлепку» и, наконец, интернализацией или «сбрасыванием» перекрестно-связанных рецепторов. Хотя образование «пятен» и «нашлепок» рецепторов часто происходит в клетках, подвергающихся действию мультивалентных лигандов, таких, как иммуноглобулины и пектины, при взаимодействии рецепторов с моновалентными лигандами, такими, как гормоны и трансмиттеры, переход «пятен» в «нашлепку» может и не наблюдаться. Тем не менее процессы, ведущие к агрегации и интернализации мультивалентных лигандов, все же могут иметь отношение к кругообороту и судьбе рецепторов пептидных гормонов, особенно в ходе регуляции рецепторов при повышении концентрации гормональных лигандов. По данным современных исследований, описанным далее, перераспределение рецепторов гормонов и других одновалентных лигандов предшествует интернализации рецепторных агрегатов с последующим разрушением комплексов.
Зависимость интернализации гормона от вызываемой лигандом потери рецепторов отчетливо показана на примере действия фактора роста эпидермиса (ФРЭ) на фибробласты человека [24]. Связавшийся с клетками митоген быстро распадается в ходе процесса, соответствующего интернализации и лизосомному разрушению, причем одновременно из клетки исчезают поверхностные рецепторы ФРЭ. Потеря рецепторов ФРЭ после связывания пептида продемонстрирована также с помощью аффинной метки, показавшей, что быстрый протеолитический распад гормонрецепторных комплексов сопровождается уменьшением числа рецепторных участков на клеточной мембране. Как изменение числа рецепторов, так и синтез ДНК достигали половины максимума своей реакции при насыщении митогеном 10% рецепторов. Путем увеличения изображения удалось непосредственно наблюдать интернализацию флюоресцирующих аналогов ФРЭ, инсулина и гонадотропин-рилизинг гормона (ГнРГ); при этом выяснилось, что гормонрецепторные комплексы вначале распределяются по клеточной мембране равномерно, а затем быстро агрегируют в «пятна», которые проникают внутрь клетки в форме эндоцитозных пузырьков, присутствующих в цитоплазме [25].
Дальнейшие доказательства интернализации гормона были получены при изучении поглощения и метаболизма гонадотропинов в клетках семенников и яичников. Присутствие гонадотропинсвязывающих мест в цитоплазме яичниковых клеток было показано с помощью методов иммуноцитохимии и авторадиографии. После воздействия ХГЧ in vivo гормон обнаруживался в цитоплазме, на мембране и в перинуклеарном пространстве. Более прямые доказательства были получены в экспериментах на желтом теле овцы, где значительные количества меченного 125I ХГЧ поглощались клеткой в форме эндоцитозных пузырьков и включались в плотные тельца (предположительно лизосомы). Лизосомная деградация гонадотропинов встречалась также в опухолевых клетках Лейдига, в которых на связывание и метаболизм меченного 125I ХГЧ не влияли агенты, изменяющие состояние микронитей и микротрубочек [26]. Потеря рецепторов гонадотропина, вызываемая ХГЧ в яичниках, сопровождалась прогрессирующей интернализацией связанного с рецепторами 125I-ХГЧ, причем после солюбилизации я центрифугирования в градиенте плотности часть транслоцированной радиоактивности удалось идентифицировать в качестве гор-монрецепторного комплекса. Полученные данные свидетельствуют о том, что ингернализация является частым следствием гормон-рецепторного взаимодействия и, по всей вероятности, именно ею определяется снижающая регуляция поверхностных рецепторов после воздействия повышенных концентраций гомологичного гормона [18].
Дата добавления: 2015-01-19; просмотров: 1344;
