Тема 2.1. Электронная природа одинарной и кратных связей
Электронные представления явились следующим этапом развития классической теории строения органических соединений А.М. Бутлерова. Положение атома углерода в таблице Д.И. Менделеева во многом определяет его свойства.
1. Электронная структура оболочки атома углерода в невозбужденном (I) и возбуждённом (II) состояниях имеет вид:
С n = 2 C* n = 2
1S2 2S2 2P2 1S2 2S 1 2P3
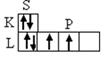 ( Ι )
( Ι ) 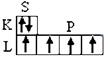 (ΙΙ )
(ΙΙ )
В момент образования органических соединений атом углерода из невозбужденного состояния переходит в возбужденное, характеризующееся распариваем s-электронов. В возбужденном состоянии валентные электроны располагаются на четырех орбиталях, различных по конфигурации и пространственной направленности. Эти орбитали при образовании связей претерпевают гибридизацию и образуют четыре эквивалентные по форме, энергии и направленности гибридные орбитали, имеющие форму неправильной восьмерки.
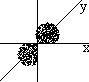
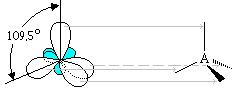

Валентный угол между гибридными орбиталями ― 109◦29׀. Этот тип гибридизации называется sp3-гибридизацией и имеет место в ряду алканов.
2. Электронная природа двойной связи.
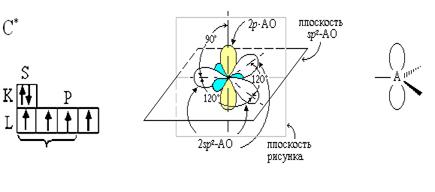
Если в гибридизации участвует 1-s и 2-p электрона, то это sp2-гибридизация, при этом образуется три гибридные орбитали, также имеющие форму неправильной восьмерки с валентным углом между ними 120◦. Два неспаренных р-электрона двух атомов углерода образуют π-связь, которая располагается перпендикулярно плоскости молекулы. Молекула этилена плоская. Этот тип гибридизации мы наблюдаем в ряду алкенов (СН2 ═ СН2).
Энергия δ–связи – 350 кДж/кг;
Энергия π–связи – 257 кДж/кг;
∑ δ + π = 607 кДж/кг;
Длина δ-связи – 0,154 нм;
∑ δ + π = 0,134 нм – двойная связь.
3. Электронная природа тройной связи.
Если в гибридизации участвуют 1-s и 1-p электроны, то это sp-гибридизация. Этот тип гибридизации мы наблюдаем в ряду алкинов (Н - С º С - Н).
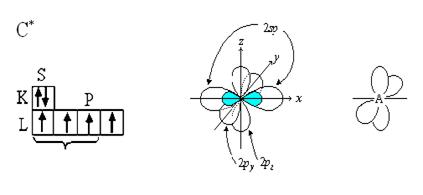
В результате sp-гибридизации образуются две гибридные орбитали, имеющие форму неправильной восьмерки с валентным углом между ними 180◦. Четыре не участвующих в гибридизации р-электрона двух атомов углерода образуют две π-связи, расположенные во взаимно перпендикулярных плоскостях.
Энергия связи π2 = 215, 6 кДж/кг;
∑ δ + π1 + π2 = 822,6 кДж/кг;
Длина ∑ δ + π1 + π2 = 0,12 нм.
Дата добавления: 2015-03-19; просмотров: 1453;
