Лекція №5
Навчальні питання:
1. Виробництво кольорових металів.
2. Руди, технологічні процеси та устаткування при виробництві алюмінію, міді, магнію, титану.
3. Властивості основних кольорових металів.
4. Способи рафінування металів
Навчальне питання 1. Виробництво кольорових металів.
Кольорові метали та їх сплави відзначаються високою технологічністю і корозійною стійкістю. Вони є основними конструкційними матеріалами в новітніх галузях промисловості: в електро- і радіотехніці, авіації і космічній техніці. Дедалі ширше використовуються в будівництві, с/г, харчовій та хімічній промисловості.
Кольорова металургія — галузь промисловості, що охоплює добування і збагачення руд кольорових металів, виробництво та обробку кольорових металів та їх сплавів.
Продукція кольорової металургії широко використовується у точному машинобудуванні, літакобудуванні, електроніці, робототехніці і т. д.
Кольорова металургія в Україні розвинута недостатньо через брак власної сировини.
Виробництво кольорових металів переважно енергоємне (потребує багато електроенергії), тому підприємства розташовують поблизу джерел дешевої електроенергії.
Підприємства кольорової металургії є одним з основних стаціонарних джерел забруднення середовища. Вони викидають в атмосферу оксиди азоту, сірчистий газ. Ґрунти забруднюються свинцем, цинком, хромом, міддю. Значні земельні площі доводиться вилучати під звалища промислових відходів.
Складність розвитку галузей кольорової металургії зумовлена їх високою енергоємністю, водоємкістю і матеріаломісткістю. Тому виплавка кольорових металів в Україні зменшується.
Навчальне питання 2. Руди, технологічні процеси та устаткування при виробництві алюмінію, міді, магнію, титан
Мідні руди і підготовка їх до плавки.
Сировиною для виробництва міді є сульфідні мідні руди (СuS, Сu2S, СuFеS2, Сu3FеS3) і окислені (СuО, Сu20, СuСОз, Сu(ОН)2). До 80% міді добувають із сульфідних руд, 15—20% —з окислених. Вміст міді в рудах звичайно становить 1—3%. Мідні руди містять у собі також невелику кількість цинку, свинцю, срібла, золота та інших металів. До складу пустої породи мідних руд входять кварц, глинозем, вапняк і різні силікати.
Усі мідні руди перед плавкою збагачують методом флотації. Для цього руду подрібнюють і розмелюють до зерен розміром 0,05—0,5 мм, а потім засипають у флотаційну машину. Тут вона перемішується з водою і утворює пульпу. У ванну флотаційної машини добавляють смерекову (ялинову) олію, яка сприяє утворенню на поверхні зерен рудних мінералів погано змочуваної водою плівки. Якщо тепер продувати пульпу стисненим повітрям, то ці дрібні зерна прилипають до бульбашок повітря і виносяться ними на поверхню води, утворюючи піну. Піна безперервно видаляється з машини. Після фільтрації і сушіння з неї утворюється мідний концентрат. Часточки пустої породи, добре змочувані водою, осідають на дно машини, звідки в міру нагромадження видаляються у відвал. Збагачення сульфідних мідних руд методом флотації дає змогу мати концентрат, який містить 15—30% міді.
Мідний концентрат перед плавкою випалюють у багатоподових вертикальних печах або в киплячому шарі (в завислому стані).
Способи вироблення міді. Добувають мідь з руд пірометалургійним або гідрометалургійним способом. Гідрометалургійний спосіб застосовують порівняно рідко — тільки для переробки мідних окислених руд. Пірометалургійним способом мідь добувають з сульфідних мідних руд плавленням концентрату їх у полуменевих відбивних печах або кускової руди в шахтних печах. У мідеплавильній промисловості тепер застосовують переважно плавлення в полуменевих відбивних печах. Виробництво міді з сульфідних руд ; складається з трьох послідовних етапів; 1) плавлення мідного концентрату у відбивній печі для вироблення мідного штей- ну; 2) переробки мідного штейну на чорнову мідь; 3) рафінування чорнової міді.
|
Вироблення мідного штейну. У сучасні полуменеві відбивні печі завдовжки до 40 м і завширшки 6-—8 м завантажують одночасно понад 100 т концентрату або дрібної руди. У цих печах температура досягає 1500—1600° С при спалюванні найбільш дешевих і недефіцитних сортів виплавлення чорнової міді.
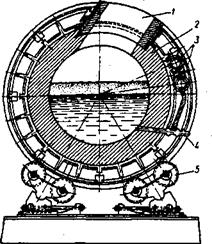
Рис. 41 Схема конвертора для палива.
У результаті плавлення на поді печі утворюється розплав сульфідів міді і заліза (мідний штейн). Звідси його випускають у ковші. Склад мідного штейну: 20—50% Сu; 20—40% Fе; 22— 25% S; до 8% О2 і домішки — золото, срібло, цинк, нікель та ін. Пуста порода відокремлюється від штейну у вигляді шлаку.
Виплавлення чорнової міді. Рідкий мідний штейн продувають у конверторах повітрям, внаслідок чого утворюється так звана чорнова мідь. Найбільш поширеними в промисловості є горизонтальні конвертори. На рис. 41 показано горизонтальний конвертор, який виготовляють діаметром 3—4 м, завдовжки 6—10 м і місткістю до 75 т. Зсередини конвертор обкладено магнезитовою цеглою 2. Установлений він на роликах 5 і має механічний привод для повертання. У горловину 1 заливають мідний штейн, засипають на поверхню залитого розплаву кремнезем, потрібний для відшлакування. закису заліза, і подають дуття. Повітря підводиться під тиском 0,07—0,12 Мн/м2 (0,75—1,25 ат) по трубах 3 і спрямовується у фурми 4, розміщені вздовж конвертора.
Процес продування ведуть у дві стадії. У першій стадії окислюються сульфіди заліза і відшлаковується закис заліза:
2FеS + ЗО2 + SiO2 = (FеО)2 * SiO2 + 2SО2 + Q.
Шлак зливають у горловину і замість нього вводять нові порції штейну. Продувания проходить при температурі 1200—1300° С, яка підтримується за рахунок тепла хімічних реакцій. Після зливання шлаку залишається чиста напівсірчиста мідь Сu2S(білий штейн), яка в другій стадії переробляється на чорнову мідь за такими реакціями:
2Сu2S + ЗО2 =2Сu2О + 2SO2 + Q
Сu2S + 2Сu2О = 6Сu + ЗО2 — Q.
Тривалість процесу продування штейну на чорнову мідь залежить від вмісту міді в штейні та від місткості конвертора і становить 15—20 год. Для прискорення процесу застосовують кисневе дуття. Вироблену чорнову мідь розливають у плити або чушки і потім рафінують, щоб звільнитись від розчинених у ній газів і різних домішок.
Рафінування чорнової міді (очищення її від домішок) проводять двома способами: вогневим і електролітичним.
Вогневе рафінування ведуть у полуменевих відбивних печах, схожих за конструкцією на печі для виробництва мідного штейну. Чорнову мідь завантажують у піч і розплавляють, домішки окислюють продуванням крізь розплавлений метал повітря під тиском 0,15—0,20 Мн/м2 (1,5—2 ат). Оксиди сірки, сурми, цинку, свинцю, що утворилися, видаляються з димовими газами, а інші оксиди переходять у шлак. Золото і срібло залишаються розчиненими в міді. Поряд з окисленням домішок окислюється і мідь. Для відновлення окисленої міді і для видалення розчинених газів метал перемішують дерев’яними жердинами. Цей процес називається «дражненням.» міді. При проведенні його мідь відновлюється вуглецем деревини:
Сu2О + С = 2Сu + СО — Q;
Сu2О + СО = 2Сu + СО2 + Q.
Чорнову мідь розливають у форми і дістають злитки, або анодні плити, для наступного електролітичного рафінування.
Електролітичне рафінування застосовують, щоб виробити найчистішу, високоякісну мідь (не менше 99,99% Сu) і виділити з неї благородні метали (платину, золото, срібло). Електролізні ванни являють собою довгі прямокутні резервуари, наповнені 12—16%-ним водним розчином мідного купоросу в сірчаній кислоті, в якому підвішені поперемінно аноди і катоди. Корпус ванни виготовляють з дерева або бетону, а зсередини його викладають шаром пластмаси. Установлюють корпус на скляні ізолятори. Анодами є плити з червоної міді масою 200— 250 кг, а катодами — тонкі листи (0,5—0,7 мм) електролітичної міді. Під час пропускання електричного струму через ванну анод розчиняється і на катоді осаджуються іони міді. Протягом 10— 12 днів на катоді збирається до 100 кг електролітичної міді. Катодні пластини потім переплавляють у печах і розливають у злитки потрібного перерізу. При електролізі частина домішок, що є в аноді, не розчиняється і осаджується на дно ванни у вигляді шламу, який періодично випускають з ванни і піддають дальшій обробці для виділення з нього благородних металів.
Алюмінієві руди. Найбільш поширеними алюмінієвими рудами є боксити, каоліни, нефеліни й алуніти, де алюміній міститься у вигляді глинозему А12Oз (у бокситах 40—60%, а в решті руд — 22—32%).
Виробити чистий алюміній безпосереднім відновленням його з руд неможливо, оскільки домішки відновлюються раніш за нього. Тому у виробництві алюмінію є три самостійних технологічних процеси: 1) добування глинозему з алюмінієвих руд; 2) добування первинного алюмінію; 3) рафінування первинного алюмінію.
Добування глинозему. Залежно від складу алюмінієвих руд глинозем з них добувають такими способами: лужним, кислотним і електрометалургійним. В СРСР найбільш поширені такі способи: сухий лужний (спікання) —для перероблення бокситів з високим вмістом кремнезему й окису заліза; мокрий лужний — для перероблення малокремнезеуистих алюмінієвих руд; електрометалургійний — для перероблення бокситів, які містять у собі до 20% кремнезему.
При сухому і мокрому лужних способах обробляють алюмінієві руди лугами. Глинозем при цьому зв’язується в алюмінат натрію А120з • N830. При вилуговуванні алюмінат натрію переходить у розчин, а окиси і гідроокиси заліза, титану і кремнію випадають в осад. Після відокремлення від осаду розчин алюмінату натрію продувають газом С02 (сухий спосіб) або піддають гідролізу (мокрий спосіб). У результаті розчин розкладається з виділенням кристалічного осаду — гідрату окису алюмінію 2А1(ОН)3. Цей осад фільтрують, промивають, прожарюють і дістають чистий глинозем:
2А1 (ОН)з = А12O3 + ЗН2O.
При електрометалургійному способі добування глинозему складається з двох стадій: електрометалургійної і хімічної. Перша стадія проходить так: агломерат (боксит, залізну руду, барієві солі і антрацит) розплавляють в електропечах при температурі 1800° С. Продуктами плавлення є феросиліцій і шлак у вигляді алюмінатів барію. їх зливають у ківш і витримують до температури твердіння шлаку (близько 1500° С). Потім рідкий феросиліцій випускають з ковша і використовують у металургійному виробництві, а твердий шлак подрібнюють і обробляють содою:
Al2O3 • ВаО +Na2С03 = А12O3 • Na2O + ВаСO3.
Утворений алюмінат натрію відомими вже нам способами переробляють у глинозем, а вуглекислий барій використовують для виготовлення агломерату. Електроліз глинозему. Первинний алюміній добувають електролізом чистого глинозему, розчиненого в в розплавленому кріоліті Na3AlF6.
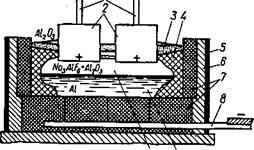
Електролізна ванна-електролізер (рис. 42) — має стальний кожух 5, обкладений із середини вогнетривкою цеглою 6.
 10 9
Рис. 42. Схема електролізної ванни для добування алюмінію.
10 9
Рис. 42. Схема електролізної ванни для добування алюмінію.
|
Під ванни і її стінки 7 зроблено з вугляних блоків, до яких підведено катодні шини 8.
Над ванною на анодних шинах 1 підвішено вугляні електроди 2. У наш час найбільше застосовуються ванни з набивними анодами, в яких вугляна маса вміщена в прямокутні алюмінієві кожухи.
Перед початком електролізу на під ванни насипають тонкий шар меленого коксу, впритул до поду опускають електроди і вмикають постійний струм. Коли вугляна футеровка ванни нагріється, у ванну поступово засипають кріоліт і розплавляють його, одночасно повільно піднімаючи електроди. Після утворення шару 200—250 мм розплавленого кріоліту 10 у ванну завантажують глинозем 3, який і розчиняється в кріоліті. Процес електролізу відбувається при температурі 930—950°С. При проходженні струму через електроліт глинозем розкладається і на аноді виділяється кисень, який утворює з вуглецем чадний газ СО, а на катоді — алюміній. Рідкий алюміній 9 нагромаджується на поді ванни і періодично видаляється сифоном або вакуум-ковшем. На бічній поверхні робочого простору ванни утворюється кірка 4 електроліту, яка захищає футеровку від руйнування під впливом розплавлених фтористих солей і від витікання струму.
В електролізній ванні, де сила струму становить 50 000 а, а напруга - 5-10 в, виробляють близько 350 кг алюмінію на добу.
Рафінування первинного алюмінію. Очищають алюміній від домішок звичайно в закритому ковші продуванням хлору протягом 10—15 хв при температурі 750—770°С. Після цього його розливають у чушки. Для вироблення алюмінію високої чистоти (до 99,99% А1) його піддають електролітичному рафінуванню, при якому забруднений домішками алюміній є анодом, а чистий алюміній — катодом. Як електроліт використовують рідкі хлористі і фтористі солі.
Магнієві руди. Як сировину для виробництва магнію використовують магнезит, доломіт, карналіт і бішофіт.
Магнезит — природний карбонат магнію MgCO3 — містить до 28,8% Mg. Перш ніж переробляти, його випалюють при температурі 800—900°С, щоб мати каустичний магнезит — окис магнію:
MgCO3 =MgO + СO2.
Доломіт — подвійний карбонат магнію і кальцію MgCO3*СаСО3, в якому вміст окису магнію становить 14— 22%. Підготування доломіту полягає в механічному збагаченні і випалюванні його. Під час випалювання відбувається така реакція:
MgC03 • СаСO3 = MgO * CaO + 2СО2.
Карналіт — це подвійний хлорид магнію і калію MgCl2*КС1*6Н20. Вміст хлористого магнію в ньому становить 12— 30%. Природний карналіт механічно збагачують і гідрохімічно оброблящть, внаслідок чого утворюється штучний карналіт MgCl2*6H20.
Бішофіт — шестиводний хлорид магнію MgCl2 • 6Н2O, який містить до 12% Mg. Бішофіт добувають, випаровуючи морську воду або розсілозер.
Виробництво магнію здійснюють електролітичним і термічним способами.
Електролітичний спосіб складається з таких операцій: виділення чистих безводних солей магнію, електроліз їх у розплавленому стані, рафінування магнію.
Залежно від складу сировинних матеріалів хлорид магнію добувають зневоднюванням кристалогідратів хлористих солей магнію або хлоруванням кисневих його сполук. Штучний карналіт і бішофіт зневоднюють у дві стадії. Перша здійснюється в трубчастій обертовій печі завдовжки 40 м і діаметром 3 м, де при повільному нагріванні руди до 220—420° С випаровується основна маса води. Друга стадія — зневоднення і виділення розплавленого MgCl2 — відбувається в електричних печах при температурі 750—800° С. Магнезіт і доломіт, які містять кисневі сполуки магнію, хлорують. Для цього, подрібнивши ці руди, перемішують їх з графітом, пресують у брикети і завантажують в електропіч, де при температурі 800—900° С обробляють хлором, що й приводить до утворення MgCl2.
Електроліз хлоридів магнію проводять у герметичних ваннах. Ванну заповнюють електролітом з розплаву MgCl2 і безводних хлористих солей KCl, NaCl та СаС12. Катоди і аноди виготовлені відповідно із сталі і графітую.Під час електролізу, що відбувається при температурі 700—750° С, MgCl2 розклада- еться в катодному Просторі виділяється розплавлений магній, який спливає на поверхню електроліту. В анодному просторі при цьому виділяється хлор, який відсмоктується через трубопровід. Катодний і анодний простори відокремлені один від одного вогнетривкою діафрагмою. Магній-сирець, який утворився, відсмоктують вакуумним ковшем з катодного простору і відправляють на рафінування.
Рафінування проводять у тигельних печах, де магній-сирець переплавляють із спеціальними флюсами. Проте найкраще очищають (до 99,99% Мд) магній сублімацією в глибокому вакуумі (13—126 н/м2, або 0,1—0,2 мм рт. ст.) при температурі 600° С. Після рафінування магній переплавляють і розливають у злитки.
Термічний спосіб виробництва магнію — це відновлення його з окису за допомогою вуглецю, кремнію або карбіду кальцію при високих температурах і глибокому вакуумі. Вироблений магній відправляють на рафінування.
Титанові руди — це рутил ТiO2, ільменіт FеО • ТiO2 і титаномагнетит— суміш ільменіту з оксидами заліза FезО4 і (частково) Fе2Oз. Титанові руди збагачують флотацією або магнітною сепарацією, внаслідок чого утворюється концентрат з високим вмістом оксиду титану (90—99% ТіO2).
Одним з основних способів добування металевого титану з оксидів є магнієтермічний, який складається з двох стадій: вироблення чотирихлористого титану і виділення металевого титану.
Чотирихлористий титан виробляють відновленням ТіO2 і хлоруванням титану в хлораторі. Кожух 1 хлоратора (рис. 43, а) виготовляють з листової сталі і футерують ізсередини фасонною динасовою цеглою 2 з шамотним термоізоляційним шаром. Через бункер 6 у хлоратор завантажують брикети 5 пресованої суміші титанового концентрату і деревного вугілля (або графіту). Знизу через патрубок 4 в хлоратор надходить хлор. Процес хлорування відбувається при температурі 800— 850° С. Нагрівається хлоратор за допомогою нагрівальних графітових елементів 3 опору. В ньому відбувається реакція
ТiO2 + 2С + 2С12 = TiCl3 + 2СО.
Пара чотирихлористого титану ТіСl4 що утворюється, трубопроводом 7 надходить у пилоочисник 8, а потім — у конденсатор 9, де перетворюється на рідину. Рідкий чотирихлористий титан після відстоювання надходить на дальше очищення — фільтрацію і дистиляцію.
| Виділення металевого титану. З сдащедого чотирихлористого титану відновлюють металевий титан. Цей процес ведуть |
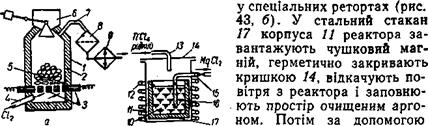
Рис. 43. Схема вироблення титану.
електронагрівника 12 реактор нагрівають до температури 800—850° С і подають у нього по трубі 13 чотирихлористий титан. Процес відновлення титану відбувається за реакцією:
ТіС14 (пара) + 2Mg(рідина) = Ті (тверде тіло) +2МgС12 (рідина).
Металевий титан виділяється у вигляді губки 16, а хлористий магній 10 відсмоктується вакуум-насосом по трубопроводу 15. Після закінчення процесу реактор охолоджують і виймають стакан з титановою губкою. Губка містить значну кількість шкідливих домішок, тому її очищають вакуумною дистиляцією. Для цього стакан з губкою поміщають у спеціальний апарат, де утворюється вакуум і одночасно здійснюється нагрівання до температури 900—950° С. Це забезпечує видалення з пор губчастої маси залишків металевого і хлооистого магнію. Після охолодження апарата стакан виймають і титанову губку відправляють на механічне дроблення. Потім подрібнену губку обробляють металокерамічним або іншими методами плавлення для того, щоб мати компактний титан.
Суть металокерамічного методу плавлення компактного титану полягає в тому, що титанові порошки пресують у заготовки і потім спікають у вакуумній печі при температурі 1050— 1100° С. Компактний титан виробляють також плавленням губки в електричних дугових печах з нейтральною атмосферою (в середовищі аргону) або у вакуумі. Для цього застосовують електродугові печі двох типів: 1) з постійним вольфрамовим електродом; 2) з пресованим електродом з титанової губки, який витрачається.
Навчальне питання 3. Властивості основних кольорових металів. Способи рафінування металів.
Кольорові метали — це промислова назва всіх металів, крім заліза. Властивості кольорових металів визначаються особливістю їхньої атомної будови. Установлена чітко виражена періодична залежність багатьох властивостей елементів від їхнього атомного номера.
Легкі та важкі метали
Кольорові метали і сплави умовно підрозділяють на легкі і важкі. До легких відносяться метали, у яких густина не перевищує 5 г/см³: магній, берилій, алюміній, титан і ін. (найлегший метал — літій — 0,536 г/см³). До важких відносять метали, у яких щільність перевищує 5 г/см³. Найважчими елементами є осмій (22,48 г/см³), іридій (22,46 г/см³), золото і вольфрам (19,3 г/см³).
Класифікація за температурою плавлення
Кольорові метали підрозділяють також за температурою плавлення. Легкоплавкі мають Тпл. до 600 °C (цинк, свинець, кадмій, вісмут, олово й ін.). Середню Тпл. (600 — 1600 °C) має мідь. Тугоплавкими вважаються метали, що плавляться при температурах вище 1 600 °C — титан, хром, ванадій, цирконій і ін.
Міцнісні характеристики
Серед кольорових металів є маломіцні, з межею міцності при розтягу σв < 50 МПа (олово, свинець, бісмут, кадмій). Практично всі метали, що є основою сучасних конструкційних сплавів (алюміній, магній, мідь, цинк, нікель і інші) мають σв до 500 МПа.
За пластичності кольорові метали підрозділяють на пластичні з відносним подовженням, δ, більше 3 — 5 % і крихкі. Більше кольорових металів є пластичними. До крихких металів відносяться бісмут, стибій, марганець. Пластичність металів сильно залежить від концентрації в них природних домішок. Чим чистіше метал, тим він більш пластичий.
Електропровідність
Більшість кольорових металів мають високу електропровідність (срібло, мідь, золото, алюміній).
Корозійностійкість
Корозійностійкими є золото, хром, ніобій, тантал, свинець. Кольорові метали є дорогими.
Часто з кольорових металів умовно виділяють такі групи:
легкі метали: алюміній, титан і магній;
важкі метали: мідь, цинк, нікель, олово і свинець, застосовуються в машинобудуванні;
дорогоцінні метали: золото, срібло і платина, використовуються переважно в ювелірній промисловості;
лужні метали: калій, натрій і літій
лужноземельні метали: кальцій, барій і стронцій, застосовуються в хімії.
рідкісні важкі метали: кадмій, вольфрам, молібден, манган, кобальт, ванадій, бісмут, використовуються в сплавах з важкими металами.
Навчальне питання 4.Способи рафінування металів.
Рафінування металів — очищення первинних (чорнових) металів від домішок. Чорнові метали, що отримуються з сировини, містять 96—99% основного металу, решта припадає на домішки. Такі метали не можуть використовуватися промисловістю через низькі фізико-хімічні і механічні властивості. Домішки, що містяться в чорнових металах, можуть мати власну цінність. Так, вартість золота і срібла, що витягують з міді, повністю окупає всі витрати на Рафінування. Розрізняють 3 основних методи рафінування: пірометалургійний, електролітичний і хімічний. У основі всіх методів лежить відмінність властивостей елементів, що розділяються: температур плавлення, щільності, електронегативності тощо. Для отримання чистих металів нерідко використовують послідовно декілька методів рафінування.
Пірометалургійне рафінування
Здійснюється при високій температурі в розплавах і має ряд різновидів. Окислювальне рафінування засноване на здатності деяких домішок утворювати з O, S, Cl, F міцніші з'єднання, ніж з'єднання основного металу з тими ж елементами. Спосіб застосовується, наприклад, для очищення Cu, Pb, Zn, Sn. Так, при продуванні рідкої міді повітрям приміси Fe, Ni, Zn, Pb, Sb, As, Sn, що мають більшу спорідненість до кисню, ніж Cu, утворюють оксиди, які спливають на поверхню ванни і видаляються.
Лікваційне розділення засноване на відмінності температур плавлення і щільності компонентів, що складють сплав, і на малій їх взаємній розчинності. Наприклад, при охолоджуванні рідкого чорнового свинцю з нього при певних температурах виділяються кристали Cu (т.з. шлікери), які унаслідок меншої щільності спливають на поверхню і видаляються. Спосіб застосовується для очищення чорнового свинцю від Cu, Ag, Au, Bi, очищення чорнового цинку від Fe, Cu, Pb, при Р. Sn і інших металів.
При фракційній перекристалізації використовується відмінність в розчинності домішок металу в твердій і рідкій фазах з урахуванням повільної дифузії домішок в твердій фазі. Спосіб застосовується у виробництві напівпровідникових матеріалів і для отримання металів високої чистоти (наприклад, зонна плавка, плазмова металургія, витягування монокристалів з розплаву, направлена кристалізація).
У основі ректифікації, або дистиляції, лежить відмінність в температурах кипіння основного металу і домішки. Рафінування здійснюється у формі безперервного протиточного процесу, в якому операції сублімації і конденсації фракцій, що видаляються, багато разів повторюються. Використання вакууму дозволяє помітно прискорити рафінування. Спосіб застосовується при очищенні Zn від Cd, Pb від Zn, при розділенні Al і Mg, в металургії Ti і інших процесах. Вакуумна фільтрація рідкого металу через керамічні фільтри (наприклад, в металургії Sn) дозволяє видалити зважені в нім тверді домішки. При рафінуванні сталі в ковші рідкими синтетичними шлаками поверхня контакту між металом і шлаком в результаті їх перемішування значно більше, чим при проведенні рафінувальних процесів в плавильному агрегаті; завдяки цьому різко підвищується інтенсивність протікання десульфурації, дефосфорації, розкислювання металів, очищення його від неметалевих включень. Редагування сталі продуванням розплаву інертними газами використовується для видалення з металу зважених частинок шлаку або твердих оксидів, що прилипають до бульбашок газу і флотують на поверхню розплаву.
Електролітичне рафінування
Електролітичне рафінування є електролізом водних розчинів або сольових розплавів і дозволяє отримувати метали високої чистоти. Застосовується для глибокого очищення більшості кольорових металів.
Електролітичне рафінування з розчинними полягає в анодному розчиненні металів, що очищаються, і осадженні на катоді чистих металів в результаті придбання іонами основного металу електронів зовнішнього ланцюга. Розділення металів під дією електролізу можливо внаслідок відмінності електрохімічних потенціалів домішок і основного металу. Наприклад, нормальний електродний потенціал Cu щодо водневого електроду порівняння, прийнятого за нуль + 0,346, у Au і Ag ця величина має більше позитивне значення, а у Ni, Fe, Zn, Mn, Pb, Sn, Co нормальний електродний потенціал негативний. При електролізі мідь осідає на катоді, благородні метали, не розчиняючись, осідають на дно електролітної ванни у вигляді шламу, а метали, що володіють негативним електродним потенціалом, накопичуються в електроліті, який періодично очищають. Іноді (наприклад, в гідрометалургії Zn) використовують електролітичне рафінування з нерозчинними анодами. Основний метал знаходиться в розчині, заздалегідь ретельно очищеному від домішок, і в результаті електролізу осідає в компактному вигляді на катоді.
Хімічне рафінування
Засноване на різній розчинності металу і домішок в розчинах кислот або лугів. Домішки, що поступово накопичуються в розчині, виділяються з нього хімічним шляхом (гідроліз, цементація, утворення важкорозчинних з'єднань, очищення за допомогою екстракції або іонного обміну). Прикладом хімічного рафінування може служити аффінаж благородних металів. Рафінування Au проводять в киплячій сірчаній або азотній кислоті. Домішки Cu, Ag і інших металів розчиняються, а очищене золото залишається в нерозчинному осаді.
Інформаційні джерела:
1. Технологія конструкційних матеріалів./За ред. А.М. Сологуба. - К.: Вища школа, 1993 –
300 с.
2. Большаков В.І., Береза О.Ю., Харченко В.І. Прикладне матеріалознавство: Підручник. Дніпропетровськ: РВА „Дніпро VAL”.2000 – 290 с.
3. Технология конструкционних материалов. /Г.А. Прейс, М.А. Сологуб, И.А. Рожнецкий/ - К.: Вища школа 1991 – 391 с.
4. Дальский А.М. и др. Технология конструкционных материалов, М.: Машиностроение. 1990 - 351 с.
Технологія конструкційних матеріалів та матеріалознавство
Дата добавления: 2015-03-14; просмотров: 2974;
