Реакции обмена протоном в растворах
Выше мы уже видели ряд специфических эффектов, коренным образом определяющих характер диссоциации электролитов-ионофоров. Это, например, стабилизирующее влияние водородной связи при образовании ионных пар в НДВС-растворителях, а также высокие константы ассоциации, характерные для плохо сольватированных ионов. Тем более природа растворителя проявляется в случае кислот, когда речь идет о разрыве ковалентной связи, например, при превращении молекулы HA в ионы A– и H+. И действительно, константы диссоциации кислот, 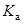
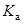 =
= 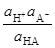 ;
; 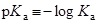
варьируют в гораздо более широких пределах, чем константы образования ионных пар – как в пределах одного растворителя, так и при переходе от одного растворителя к другому. Например, значение 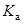 бензойной кислоты при переходе от ДМСО к ацетонитрилу уменьшается в четыре миллиарда раз!
бензойной кислоты при переходе от ДМСО к ацетонитрилу уменьшается в четыре миллиарда раз!
Кислотно-основные равновесия имеют первостепенное теоретическое и прикладное значение как сами по себе, так и при реакциях окисления-восстановления и комплексообразования. Поэтому рассмотрим их подробнее с учетом специфики растворителей различных классов.
О состоянии иона H+ в растворах – переход к кислотам
По размеру протон в примерно десять тысяч раз меньше атомов. Это создает огромную напряженность электрического поля, и поэтому свободный протон в растворе не существует. Ион лиония в любой жидкой среде представляет собой протон, внедрившийся в электронные оболочки молекулы растворителя.
Поэтому протолитические реакции протекают по двум основным механизмам: перенос протона от кислоты к молекуле растворителя и от кислоты непосредственно к основанию.
О скорости протонирования в водных растворах – см Белл и новая литература
Дата добавления: 2014-12-09; просмотров: 1673;
