ОЧИСТКА РАСТВОРИТЕЛЕЙ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С НИМИ
Органические растворители почти всегда содержат те или иные примеси. Наиболее часто встречающиеся примеси – вода и, в некоторых случаях, метиловый спирт.
Перед использованием растворители как правило подвергают очистке. Очистка растворителей описана в фундаментальных руководствах Вайсбергера с соавторами, Денеша, Гордона и Форда[8] и во многих других книгах, а также в многочисленных журнальных публикациях.
В каждом конкретном случае используются оптимальные методы очистки и хранения, с учетом химических свойств растворителей и наиболее характерных для них примесей. Глубина очистки определяется целями предстоящего применения растворителя.
Следует помнить, что растворимость кислорода и диоксида углерода в органических растворителях обычно выше, чем в воде. В то время как O2 может проявлять свои окислительные свойства, присутствие CO2 может повлиять на кислотно-основные процессы.
Вытеснение этих газов, попадающих в растворитель из атмосферы, обычно осуществляют пропусканием через жидкость сухого азота или аргона.
Одной из главных проблем является присутствие в органических примесях воды. Возможно отделение воды от очищаемого растворителя простым вымораживанием. Так, температура замерзания ДМСО составляет 18.5 оС, а безводной уксусной кислоты: 16.7 оС (отсюда термин ледяная уксусная кислота).
Первой и универсальной стадией очистки является перегонка, основанная на различии в температурах кипения основного вещества и примесей. Температура кипения (с учетом показаний лабораторного барометра) сама по себе является первичным критерием чистоты растворителя.
Многие растворители при перегонке могут в обычных условиях разлагаться, и в таком случае их перегоняют под вакуумом. Это относится, например, к ДМСО.
Во всех случаях первую и последнюю порции погонов отбрасывают. Но следует иметь в виде, что жидкости могут образовывать азеотропные смеси – примером может служить 95.5 %-ный по массе водный этанол. В этом случае необходимы эффективные водоотнимающие средства. Но в упомянутом случае возможно и использование тройного азеотропа (этанол – бензол – вода, массовое соотношение 47 : 47 : 6), позволяющее удалить примеси воды из этанола путем добавления бензола.
Спирты можно очистить от примесей альдегидов при помощи нитрата серебра. Обезвоживание спиртов часто осуществляется вначале с помощью свежепрокаленного CaO, а затем магниевой стружкой, активированной йодом. Последний прием основан на том, что образующийся в присутствии воды гидроксид магния в спиртах выпадает в осадок. Затем спирт снова перегоняют.
Неправильная очистка может испортить растворитель. Так, ацетон освобождают от примесей метанола выдерживанием с перманганатом калия, который, как известно, окисляет спирты. Но так можно поступать лишь с теми растворителями, которые сами не окисляются ионом MnO4–. В свою очередь, осушение ацетона проводят свежепрокаленными поташом или сульфатом магния, но имеются противоречивые указания относительно опасности альдольной конденсации некоторой доли ацетона в присутствии этих осушителей.
Вообще, существует целый ряд водоотнимающих веществ, таких, как Na, Ca, CaO, CaCl2, CaH2, K2CO3, MgSO4, P4O10 и многие другие. Но в каждом конкретном случае одни из них применимы, а другие нет. Часто эффективным осушающим средством оказываются цеолиты.
Из дальнейших разделов станет очевидным, что наличие даже малых количеств воды в органических растворителях может коренным образом повлиять на протекание в них различных химических реакций. Очень важно располагать методами контроля содержания воды в органических растворителях. Для этого можно использовать газовую хроматографию или титрование по Карлу Фишеру. Последний способ рассмотрим подробнее.
Определение воды по К. Фишеру заключается в титровании пробы исследуемого растворителя в безводном метаноле реагентом, состоящим из раствора йода, диоксида серы и пиридина в метаноле (I2 и SO2 находятся в виде молекулярных соединений с пиридином). Конечная точка титрования определяется по первым признакам избытка йода (контроль может быть как визуальным, так и потенциометрическим).
Первая стадия заключается в восстановлении йода до йодида:
C5H5N·I2 + C5H5N·SO2 + C5H5N + H2O 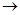 2 C5H5NH+ I– + C5H5N·SO3
2 C5H5NH+ I– + C5H5N·SO3
Вода является в этой реакции источником кислорода (в отсутствие метанола комплекс C5H5N·SO3 выделяется в виде индивидуального соединения). Вторая стадия заключается в реакции молекулярного комплекса C5H5N·SO3 с метанолом:
C5H5N·SO3 + CH3OH 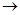 C5H5NHOSO2OCH3
C5H5NHOSO2OCH3
В отсутствие метанола в реакции потреблялась бы вода с образованием соединения C5H5NHOSO2OH. Суммарная реакция в упрощенном виде такова:
I2 + SO2 + 3 C5H5N + H2O + CH3OH 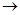 2 C5H5NH+ I– + C5H5N·SO3
2 C5H5NH+ I– + C5H5N·SO3
Проведению реакции мешают окислители и восстановители. Мешают и соединения с карбонильной группой. Альдегиды и кетоны со спиртами образуют ацетали и кетали, например:
R–CHO + 2 C2H5OH 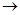 R–CH(OC2H5)2
R–CH(OC2H5)2
Поэтому в таких случаях вместо метанола используют другие растворители.
Кроме того, существует множество других методов количественного и полуколичественного контроля содержания воды в неводных средах [Ничуговский; книга Акваметрия; Шерман – тоже], например, с использованием как органических, так и неорганических индикаторов.
Конечно, помимо содержания воды важно контролировать наличие и других примесей в очищенных растворителях.
Пробы на альдегиды. См. [Черонис, Ма. Определение функциональных групп].
Полезно проверять плотность, показатель преломления и электропроводимость очищенных растворителей, сравнивая эти показатели с надежными справочными данными.
При хранении растворители могут претерпевать нежелательные превращения. Например, 1,4-диоксан с кислородом образует пероксид:
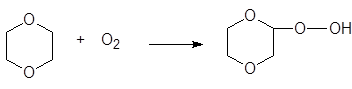
Аналогично ведет себя тетрагидрофуран. Эти пероксиды являются, во-первых, сильными окислителями, а, во-вторых, кислотами. Это может повлиять на результаты дальнейшего использования данного растворителя.
Поэтому перед очисткой от воды путем перегонки с натрием в этих растворителях нужно нейтрализовать пероксиды при помощи щелочи. Иначе может произойти сильный взрыв.
Визуальную пробу на пероксиды можно проводить при помощи тиоцианатного комплекса железа (II): красный цвет будет служить указанием на окисление железа (II) до (III). Возможно также использование йодида калия, основанное на появлении йода в присутствии окислителей.
Трихлорметан при длительном хранении может генерировать HCl. Для торможения этого процесса применяют добавки этанола (они обычно содержатся в продажном хлороформе). Но для использования CHCl3, к примеру, в качестве среды для определения констант равновесий или для других точных измерений этанол нужно удалять.
N,N-Диметилформамид в присутствии влаги постепенно разлагается на диметиламин и муравьиную кислоту. Ацетонитрил при длительном хранении также нестоек и может гидролизоваться с образованием аммиака.
Иногда непредвиденные процессы с растворителями могут протекать уже в ходе их использования. Так, ацетон в присутствии щелочей претерпевает альдольную конденсацию
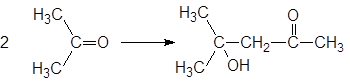
При введении в ацетон первичных аминов возможно образование оснований Шиффа:
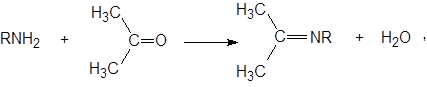
что доказывается появлением в инфракрасных спектрах полосы в области 1680 см–1, отвечающей валентным колебаниям группы C=N.
Под действием концентрированной серной кислоты образуется мезитилен:
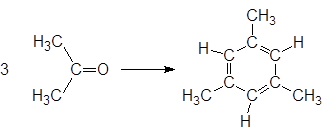 ,
,
а при пропускании хлороводорода через ацетон через некоторое время может образоваться оксид мезитила
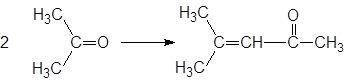 и форон:
и форон:
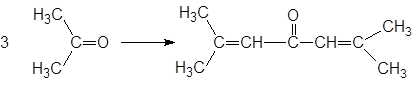
Сильные основания могут вызвать олигомеризацию ацетонитрила.
В литературе имеются указания на то, что смеси тетрахлорметана с метанолом и особенно с этанолом проявляют повышенную электропроводимость, а масс-спектрометрическое исследование смеси показало наличие HCl и CO. Вообще, вследствие высокой полярности связи углерод–хлор, CCl4 является не таким инертным соединением, как это принято иногда считать.[9]
Действие концентрированной серной кислоты на трихлорметан может привести к выделению ядовитого газа фосгена COCl2.
Охрана труда.
Приступая к работе с органическим растворителем, да и вообще с любым химическим соединением, необходимо внимательно ознакомиться с литературой о вредных веществах и о технике работы в лаборатории. Разумеется, попадание органические растворителей внутрь организма нужно полностью исключить, поскольку практически все они даже в малых дозах могут вызвать необратимые поражения внутренних органов. Поэтому прием пищи в лаборатории, особенно в процессе работы с растворителями, категорически воспрещается. Но в газообразном состоянии органические растворители тоже могут оказаться вредными; опасно и их попадание на кожу.
Метанол:сильный преимущественно нервный и сосудистый яд с резко выраженным кумулятивным эффектом. При отравлениях через желудок вызывает циркуляторный коллапс. Попадание 30 мл внутрь – уже смертельно (вызывает остановку дыхания). Даже попадание метанола на кожу может вызвать потерю зрения. Длительное вдыхание паров тоже опасно, в том числе для зрения.
1,2-Дихлорэтан вызывает дистрофические изменения в печени и почках, помутнение роговицы; способен проникать через кожу. Хлороформ негативно действует на обмен веществ и на печень. Четыреххлористый углерод действует на печень, почки, легкие и другие органы. Дихлорметан немного менее опасен, чем другие хлорпроизводные углеводородов. Нитрометанобладает резким судорожным действием.
1,4-Диоксандействует на печень и почки, вызывая необратимые изменения. Обладает кумулятивным действием. Ацетон поражает все отделы центральной нервной системы. N,N-Диметилформамид оказывает раздражающее действие на слизистые оболочки дыхательных путей, глаз, на кожу, поражает печень; способен проникать через неповрежденную кожу.
Бензол: прежде всего – очень опасный яд крови. Действует на легкие, верхние дыхательные пути, роговицу и сетчатку, на печень, сердце и другие органы. Опасно хроническое вдыхание паров бензола, а при очень высоких концентрациях может наступить потеря сознания и смерть. Хлорбензол действует на организм как бензол, но слабее. Толуол на нервную систему действует даже сильнее, чем бензол, и раздражающее действие его паров тоже сильнее. Вызывает головную боль, тошноту, изменения крови. Нитробензол при попадании в организм через рот даже нескольких капель может вызвать смерть.
Кроме того, большинство органических растворителей пожароопасны. Все работы с органическими растворителями следует вести в вытяжном шкафу, перегонку проводить в специально приспособленных для этого комнатах.
Дата добавления: 2014-12-09; просмотров: 4790;
