Значения донорных чисел Гутмана для некоторых НДВС-растворителей
| Растворитель | DN | DNN = DN/38.8 | AN |
| 1,2-Дихлорэтан | 0.0 | 0.0 | 16.7 |
| Нитрометан | 2.7 | 0.07 | 20.5 |
| Нитробензол | 4.4 | 0.11 | 14.8 |
| Ацетонитрил | 14.1 | 0.36 | 18.9 |
| 1,4-Диоксан | 14.8 | 0.38 | 10.8 |
| Сульфолан | 14.8 | 0.38 | 19.2 |
| Пропиленкарбонат | 15.1 | 0.39 | 18.3 |
| Ацетон | 17.0 | 0.44 | 12.5 |
| Этилацетат | 17.1 | 0.44 | 9.3 |
| Тетрагидрофуран | 20.0 | 0.52 | 8.0 |
| Формамид | 24.0 | 0.62 | 39.8 |
| N,N-Диметилформамид (ДМФА) | 26.6 | 0.69 | 16.0 |
| N-метилпирролидон | 27.3 | 0.70 | 13.3 |
| Диметилсульфоксид (ДМСО) | 29.8 | 0.77 | 19.3 |
| Пиридин | 33.1 | 0.85 | 14.2 |
| Гексаметилфосфортриамид (ГМФТА) | 38.8 | 1.00 | 9.8 |
| Триэтиламин | 61.0 | 1.57 | 1.4 |
Сходная шкала была предложена на основании исследования реакции молекул растворителей с другой кислотой Льюиса – BF3.
Для гидроксилсодержаших растворителей также имеются оценки значений DN, но эти данные менее надежны, ввиду сольволиза пентахлорида сурьмы.
Интересно, что наиболее популярные НДВС-растворители отчетливо разделяются по значениям DN на две группы (Табл. 6). Речь идет о катионофобных и катионофильных растворителях (Рис. 1). Высокие донорные числа растворителей указывают, естественно, и на хорошую сольватацию их молекулами также и катиона водорода. Относительно низкие (например, как у ацетона) значения говорят об обратном.
В связи с этим представляется разумным предложенное американским химиком-аналитиком И. Кольтгофом деление «апротонных», или НДВС-растворителей на протофобные и протофильные. Особенности протекания кислотно-основных реакций в НДВС-растворителях обоих типов будут нами рассмотрены в других разделах.
Обращает на себя внимание низкое значение DN нитробензола и нитрометана. Особенность нитросоединений, например, нитропарафинов, заключается в их способности вести себя подобно кислотам. Так, в случае нитрометана:
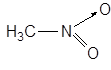
возможна диссоциация в растворах с выделением протона; в воде это соединение титруется щелочью:
CH3NO2  CH2=NO2H
CH2=NO2H  CH2NO2– + H+
CH2NO2– + H+
Электроноакцепторная способность растворителей характеризуется так называемым акцепторным числом (Acceptor Number, AN). Последнее представляет собой величину, пропорциональную химическому сдвигу 31P в спектрах ЯМР оксида триэтилфосфина в данном растворителе. Акцепторность оценивается по отношению к н-гексану и является безразмерной величиной. Для установления общей точки отсчета для параметров DN и AN выбран пентахлорид сурьмы: химический сдвиг 31P, соответствующий образованию комплекса (C2H5)3PO:SbCl5 в 1,2-дихлорэтане, принят за 100. Эти значения для избранных растворителей также представлены в Таблице 6.
| Нитрометан | 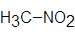
| Формамид | 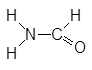
|
| Нитробензол | 
| N-Метилформамид | 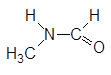
|
| Ацетонитрил |
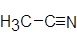
| N,N-Диметилформамид | 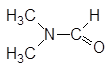
|
| Бензонитрил | 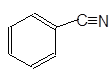
| N,N-Диметилацетамид | 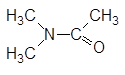
|
| Пропиленкарбонат (4-метил-1,3-диоксолан-2-он) |
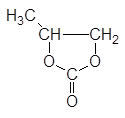
| N-Метилпирролидон | 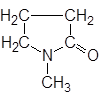
|
| Ацетон | 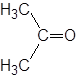
| Диметилсульфоксид | 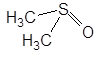
|
| Сульфолан | 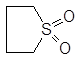
| Гексаметилфосфортриамид | 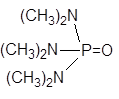
|
Рис. 1. Структурные формулы молекул полярных НДВС-растворителей; слева представлены катионофобные (протофобные), а справа – катионофильные (протофильные) растворители.
Теперь осталось еще остановиться на так называемых «зеленых» растворителях. Эти растворители – низкотемпературные ионные жидкости – называются зелеными по причине их «экологической чистоты», которая, в свою очередь, обусловлена ничтожным давлением их паров.
Сведения об ионных жидкостях, т.е. солях, существующих в расплавленном состоянии при комнатной температуре (room-temperature ionic liquids, сокращенно RTIL), в литературе имелись уже давно. Так, П. Вальден (Paul Walden) в 1914 году опубликовал данные о жидком нитрате этиламмония, H5C2NH3+NO3–, замерзающем при 13-14 оС.
Сейчас описано множество подобных растворителей, обладающих рядом уникальных свойств. Например, они используются как ценные среды для проведения различных синтезов. Примером распространенной и достаточно недорогой ионной жидкости является гексафторфосфат бутилметилимидазолиния:
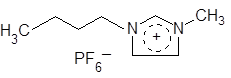
сокращенно – [bmim]+[PF6]–, tпл = 12 оС.
Дата добавления: 2014-12-09; просмотров: 3238;
