Значения плотности энергии когезии и внутреннего давления при 20 оС
| Растворитель | 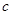 , МПа , МПа
| 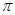 , МПа , МПа
|
| 1,4-Диоксан | ||
| Тетрахлорметан | ||
| Бензол | ||
| Ацетон | ||
| Ацетонитрил | ||
| Этанол | ||
| Метанол | ||
| Вода (25 оС) |
Распространенной характеристикой растворителя является так называемый параметр Гильдебранда: корень квадратный из плотности энергии когезии: 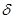 =
=  , МПа ½.
, МПа ½.
До сих пор речь шла об отношении растворителей к анионам. Отношение к катионам определяется электронодонорной способностью молекул растворителя. Мерой этой способности может служить стандартная энтальпия равновесия реакции донора электронной пары (т. е. основания Бренстеда) с акцептором электронной пары.
Такими акцепторами электронной пары могут быть так называемые кислоты Льюиса (L-кислоты). В противоположность привычным протонным кислотам, или H-кислотам, американский химик Дж. Льюис выдвинул представления об апротонных кислотах,[7] предоставляющих вакантную орбиталь для неподеленной электронной пары основания:
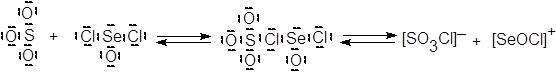
Кислотами Льюиса являются также AlCl3, FeCl3, SnCl4, SbCl5, катионы металлов и другие ионы и молекулы.
Позже австрийский химик В. Гутман предложил в качестве количественной характеристики электронодонорных свойств так называемые донорные числа (Donor Numbers, DN), выбрав в качестве стандартной кислоты Льюиса пентахлорид сурьмы (строение внешней электронной оболочки атома сурьмы 5s25p3):
D: + SbCl5  D:SbCl5
D:SbCl5
По определению, донорное число равно энтальпии этой реакции при комнатной температуре в 1,2-дихлорэтане, выраженной в ккал/моль и взятой с противоположным знаком: DN = 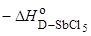 (ккал/моль).
(ккал/моль).
Наличие следов воды может привести к гидролизу SbCl5, поэтому растворитель и реагенты должны быть тщательно осушены. Некоторые численные значения DN представлены в Таблице 6. Используются также безразмерные нормированные донорные числа, DNN, отнесенные к донорному числу гексаметилфосфортриамида.
Т а б л и ц а 6
Дата добавления: 2014-12-09; просмотров: 1710;
