Физические характеристики кислых, оснóвных
и малополярных растворителей (25 оС)
| Растворитель | 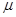 , Д , Д
| 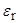
| 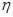 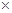 103, Па с 103, Па с
|
| Кислые: | |||
| Муравьиная кислота | 1.77 | 56.1 | 1.621 |
| Уксусная кислота | 1.73 | 6.2 | 1.13 |
| Оснóвные: | |||
| Этилендиамин | 1.90 | 12.9 | 1.54 |
| Пиридин | 2.37 | 12.3 | 0.884 |
| «Инертные» (малополярные): | |||
| 1,2-Дихлорэтан | 10.36 | ||
| Трихлорметан | 1.12 | 4.89 | 0.540 |
| Этилацетат | 6.02 | ||
| 1,4-Диоксан | 2.21 | ||
| Бензол | 2.27 | ||
| н-Гексан | 1.88 |
Важными характеристиками растворителей являются значения плотности энергии когезии и внутреннего давления жидкости.
Когезией называется явление сцепления молекул, находящихся в одной фазе. Поскольку при испарении жидкости все связи между молекулами разрываются, энергия когезии характеризуется теплотой испарения, 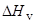 . Плотность энергии когезии,
. Плотность энергии когезии, 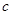 , вычисляется по формуле:
, вычисляется по формуле:
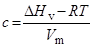 .
.
Здесь 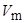 – мольный объем, а поправка RT показывает, что часть энергии расходуется на удаление испарившихся молекул на бесконечное расстояние друг от друга.
– мольный объем, а поправка RT показывает, что часть энергии расходуется на удаление испарившихся молекул на бесконечное расстояние друг от друга.
Внутреннее давление, 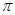 , характеризует изменение полное энергии жидкости,
, характеризует изменение полное энергии жидкости,  , при сжатии и вычисляется по формуле:
, при сжатии и вычисляется по формуле:
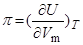 .
.
Параметры 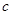 и
и 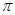 имеют размерность давления, выражаются в мегапаскалях и в некоторых (но далеко не во всех) случаях близки по численному значению. В таблице 5 представлены значения
имеют размерность давления, выражаются в мегапаскалях и в некоторых (но далеко не во всех) случаях близки по численному значению. В таблице 5 представлены значения 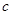 и
и  некоторых растворителей. Из этих данных следует, что серьезные расхождения в значениях этих двух параметров наблюдаются в ДВС-растворителях – в спиртах и, особенно – в воде. Этот факт лишний раз подчеркивает важность водородных связей для сцепления молекул друг с другом в жидкой фазе.
некоторых растворителей. Из этих данных следует, что серьезные расхождения в значениях этих двух параметров наблюдаются в ДВС-растворителях – в спиртах и, особенно – в воде. Этот факт лишний раз подчеркивает важность водородных связей для сцепления молекул друг с другом в жидкой фазе.
Донорами водородных связей могут быть не только вода, спирты, фенолы и кислоты. Так, замещение нескольких атомов водорода атомами галогенов может настолько ослабить остающиеся связи C–H в молекуле углеводорода, что атом водорода может приобретать некоторые признаки «кислых» свойств. Это относится, в частности, к трихлорметану (хлороформу).[6]
Т а б л и ц а 5
Дата добавления: 2014-12-09; просмотров: 1541;
