Ta hygra meikta malista ton somaton
(«есть прежде всего жидкости, которые реагируют»), которое впоследствии приняло более категоричную форму: Corpora non agunt nisi fluida («вещества не реагируют, если они не жидки»), что уже является преувеличением и не соответствует действительности. В самом деле, хорошо известны многие реакции в газовой фазе, реакции на границе газ/твердое тело, газ/жидкость, жидкость/твердое тело, а также реакции в твердой фазе – как между неорганическими, так и органическими реагентами. И, тем не менее, жидкие растворы имеют первостепенное значение для химии и смежных областей науки.
Растворами называются гомогенные системы с числом компонентов более двух. Когда речь идет о жидких растворах (а именно им посвящена настоящая брошюра), то говорят о растворе твердого тела или газа в жидком растворителе, если соответствующий компонент в свободном состоянии при данной температуре и давлении находится соответственно в твердом либо газообразном состоянии. Если речь идет о смеси жидкостей, то растворителем обычно считается преобладающий компонент.
Жидкое состояние можно рассматривать как промежуточное между твердым и газообразным. Действительно, твердое тело при нагревании чаще всего сначала превращается в жидкость, и лишь затем в пар (исключение составляют случаи так называемой возгонки (сублимации, sublimation) твердого тела).
Обычно тепловой эффект плавления на порядок меньше теплового эффекта испарения:
 <
<  ,
,
что и понятно, так как для полного разрыва всех связей между молекулами и перевода молекул в практически изолированное состояние в газовой фазе требуется гораздо больше затрат энергии, чем для плавления.
В жидкостях молекулы не вынуждены колебаться около определенных положений (отсутствие «дальнего порядка»), как в твердом теле, но и не могут беспрепятственно перемещаться по всему объему, как в газе. Жидкости объединяют с твердыми телами названием «конденсированные фазы», а жидкости вместе с газами называют «флюидами».
В классической физической химии жидкости рассматривали скорее как сжиженные газы. Для 1 моля идеального газа справедливо уравнение Менделеева–Клапейрона:
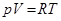 ,
,
которое для реальных газов переходит в уравнение ван-дер-Ваальса:
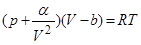 .
.
По мере сжатия поправка на объем, занимаемый молекулами газа,  , все сильнее приближается к величине
, все сильнее приближается к величине  , а прибавка к давлению за счет взаимодействия молекул,
, а прибавка к давлению за счет взаимодействия молекул, 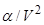 , становится все больше. После перехода газа в жидкость величина
, становится все больше. После перехода газа в жидкость величина 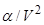 превращается во внутреннее давление жидкости, существенно превышая значение
превращается во внутреннее давление жидкости, существенно превышая значение  и составляя тысячи атмосфер.
и составляя тысячи атмосфер.
С другой стороны, результаты рентгеноструктурного анализа и исследование дифракции электронов указали на некоторые аналогии между жидким и твердым состоянием. Далее, было показано, что наряду с «ближним порядком» в жидкостях могут обнаруживаться и признаки дальнего порядка, как в твердых телах; имеется ряд физических моделей жидкости (ячеечная, дырочная).
Различные точки зрения на свойства жидкости можно согласовать с учетом температуры: вблизи температур замерзания и кипения в большей мере проявляется сходство жидкости с твердым телом и газом, соответственно.
Наряду с многочисленными органическими жидкостями, а также жидким аммиаком, гидразином, диоксидом серы и т.п. существуют и такие своеобразные, как, например, металлическая жидкость – ртуть.
Наиболее привычным и повсеместно распространенным растворителем является вода. Строение молекулы H2O хорошо известно:
Угол = 105 о
Вода – самый древний в истории человечества растворитель. Но, в сущности, и один из самых необычных. В частности, хотя молярная масса воды равна 18.02, при p = 1.01325.105 Па эта жидкость кипит лишь при 100 оС ! В то же время, более тяжелые молекулы, такие, например, как O2, N2, CO2, C4H10 и H2S, уже при комнатной температуре находятся в газообразном состоянии.
Причиной такого поведения воды является наличие прочной трехмерной «сетки» водородных связей (H-связей), сцепляющих молекулы жидкости друг с другом.[1] Структуре жидкой воды посвящено множество работ.
Бернал и Фаулер
По О. Я. Самойлову, четко выраженный ближний порядок обусловлен H-связями; молекулы образуют ажурный тетраэдрический каркас, а часть молекул H2O
Трансляционные движения
См новый обзор
Повышение плотности при переходе от 0 оС к 4 оС
(при p = 1.01325.105 Па максимальная плотность H2O – при 277.13 К).
Таким образом, вода – довольно необычный растворитель. Поэтому деление растворителей на воду и неводные растворители, а последних – на «водоподобные» и прочие – не случайно.
Зачем для технологии и научных исследований нужны неводные растворители? В чем преимущества их перед водой?
1) Прежде всего, широкий ассортимент растворителей нужен для обеспечения хорошей растворимости веществ.[2] Многие часто используемые соединения, прежде всего – органические, недостаточно хорошо растворимы либо вовсе (практически) нерастворимы в воде. Так, лекарственные настойки готовят на водно-этанольных смесях, а некоторые полимеры растворяются в бензоле и его смесях со спиртами.
Особенно важно то, что растворитель может очень сильно, иногда до неузнаваемости изменить свойства растворенных веществ. Путем правильного подбора растворителя можно целенаправленно влиять на положение химического равновесияискорость химической реакции.
3) Это очень важно, в частности, при проведении органических синтезов, в том числе и процессов полимеризации и фотополимеризации (под словами «синтез без растворителя» обычно подразумевается жидкофазный синтез, при котором растворителем являются сами реагенты).
4) Многие коллоидные синтезы, используемые, в частности, для получения наноразмерных частиц методами физической или химической конденсации, проводятся в неводных растворителях (получение органозолей, и т.п.).
5) Перекристаллизация является простым и наиболее важным способом очистки химических веществ. При этом растворитель должен быть подобран таким образом, чтобы растворимость в нем вещества была значительной при высокой температуре, но существенно снижалась при охлаждении раствора.
6) Ограниченно смешивающиеся или практически не смешивающиеся с водой растворители (хлороформ, бензол, толуол, нитробензол, 1-октанол и другие) используют для экстракциимногих веществ из водных растворов – как в аналитической и препаративной практике, так и в технологических процессах.
7) В химическом анализе широко используются титрования всех видов (кислотно-основные, окислительно-восстановительные, осадительные, и т.д.) в среде органических растворителей.
8) В жидкостной хроматографии в качестве подвижной фазы используются разнообразные органические и водно-органические растворители.
9) Закономерности комплексообразования ионов металлов с лигандами, в том числе с макроциклическими (краун-эфиры, криптанды, сферанды, каликсарены и т.п.), часто изучают в органических растворителях.
10) Замена воды на неводные растворители может кардинально изменить характер протекания электродных процессов. Так, в «ряду напряжений», основанном на водных растворах, медь стоит после водорода, но в ацетонитриле медь уже может вытеснять водород из растворов. Применение неводных сред позволило В. А. Плотникову выделить алюминий в процессе электролиза. Вольтамперометрию, в частности, полярографию, сегодня невозможно представить без использования диметилсульфоксида, диметилформамида, ацетонитрила и других органических растворителей.
11) Для протекания реакций образования и взаимопревращения свободных радикаловудобными средами являются алифатические и ароматические углеводороды (гексан, бензол и др.).
12) Многие свойства растворителя, особенно его вязкость, могут существенно воздействовать на протекание фотофизических процессов в жидкой фазе.
13) Химическая природа растворителя может вследствие межмолекулярных взаимодействий заметно сказываться на инфракрасных и электронных спектрах поглощения, а также и наспектрах флуоресценции.
14) Металлургия (см А. Паркер) Izutsu
Этот перечень можно было бы продолжить, но и без того уже очевидно, насколько важно располагать большим ассортиментом растворителей и уметь осознанно их применять.
Ключевым, хотя и многозначным является понятие о сольватации – взаимодействии растворенного вещества с растворителем. Обычно подразумевается, что при этом дело не доходит до разрушения прежних и образования новых ковалентных связей между атомами, т.е. до возникновения новых химических соединений – такое сильное взаимодействие называют уже сольволизом.
Термин «сольватация» вошел в обиход химиков в конце XIX – начале XX столетия в результате работ И. А. Каблукова и П. Вальдена. Современное понимание термина передает следующая формулировка, данная Г. А. Крестовым:
«Под сольватацией понимается вся сумма энергетических и структурных изменений, происходящих в системе в процессе перехода при заданных условиях атомно-молекулярных частиц (атомов, молекул, ионов, радикалов) [из вакуума] в жидкую фазу растворителя, приводящих к образованию раствора определенной химической структуры и заданного состава (исключения составляют изменения, сопровождающиеся разрывом химических связей в самих атомно-молекулярных объектах и молекулах растворителя)».
Термодинамика растворения и сольватации различных соединений в органических растворителях, закономерности влияния природы растворителя на равновесия и кинетику реакций начали исследоваться более столетия тому назад многими учеными. Внесли свой вклад в эту область знаний и харьковские химики, работавшие в Императорском Харьковском университете в XIX и в первые послереволюционные годы (П. Д. Хрущов, В. Ф. Тимофеев, И. П. Осипов, Г. Е. Тимофеев, Г. Е. Мухин и другие).
Эти традиции были продолжены и развиты Н. А. Измайловым (1907–1961), который создал всемирно известную школу физико-химии неводных растворов. Отдельные направления исследований были в дальнейшем развиты учениками Н. А. Измайлова – А. М. Шкодиным, В. В. Александровым, В.Д. Безуглым, Е. Ф. Ивановой и другими.
Дата добавления: 2014-12-09; просмотров: 1308;
