ЭЛЕКТРОЛИТЫ В РАСТВОРАХ
Электролитами принято называть химические соединения, растворы которых проводят электрический ток. Для объяснения этого свойства электролитов С. Аррениус в 1883 году выдвинул теорию электролитической диссоциации, которая оказалась одной из наиболее революционных в химии.[10]
Первоначально идея распада электролита на ионы, как известно, отвергалась.[11] Во-первых, именно незнание химических свойств ионов не позволяло понять, насколько сильно они отличаются от свойств соответствующих атомов (молекул). Так, казалось немыслимым существование катиона натрия и аниона хлора в водном растворе NaCl на том основании, что натрий бурно реагирует с водой, а хлор – это газ зеленого цвета. Во-вторых, трудно было понять, что может заставить отделиться друг от друга в растворе положительный и отрицательный заряды, которые должны притягиваться в соответствии с законом Кулона.
Поэтому, в частности, теорию Аррениуса, поддержанную В. Оствальдом и Я. Г. Вант-Гоффом, не принимали такие авторитеты, как Д. И. Менделеев и Н. Н. Бекетов. Менделеев и, в еще большей степени Ф. М. Флавицкий, стремились объяснить все свойства электролитов в растворах образованием гидратов (а в общем случае – сольватов) молекул. В свою очередь, Аррениус и Оствальд никак не объясняли причину распада молекул на противоположно заряженные ионы.
Впоследствии, благодаря усилиям И. А. Каблукова и других ученых, был осуществлен синтез представлений об электролитической диссоциации и сольватации. Именно сольватация ионов и является фактором, обеспечивающим их стабильность в растворе. Например, дипольные молекулы растворителя ориентируются по отношению к иону своими противоположно заряженными концами, в воде и спиртах возможно образование водородных связей с анионами, и т.п.
Другими словами, взаимодействия ионов с молекулами растворителя, как универсальные (здесь – ион–дипольные) так и специфические (например, водородные связи) снижают энергию ионов в растворе, тем самым способствуя электролитической диссоциации. И действительно, значения энергии Гиббса гидратации (т. е. переноса из вакуума в воду) ионов, полученные сочетанием современных экспериментальных и теоретических методов, могут составлять несколько сотен или даже тысяч килоджоулей на моль. Следовательно, гидратация сопровождается значительным выигрышем энергии, по абсолютной величине соизмеримым с энергией разрушения кристаллической решетки. В термодинамической шкале последняя величина имеет знак «плюс», а энергия гидратации – «минус».
Дать таблицу энергий Гиббса гидратации
Вначале исследования электролитической диссоциации касались главным образом водных растворов и велись почти исключительно при помощи метода электропроводимости. Степень диссоциации, 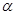 , находили по уравнению Кольрауша:
, находили по уравнению Кольрауша:
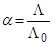 ,
,
используя значения молярной проводимости, 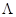 , при концентрации
, при концентрации 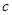 и предельной (т.е. соответствующей бесконечному разведению) молярной проводимости электролита,
и предельной (т.е. соответствующей бесконечному разведению) молярной проводимости электролита, 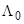 , и далее вычисляли константу диссоциации:
, и далее вычисляли константу диссоциации:
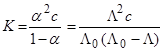 .
.
В результате, наряду с вполне разумными значениями констант диссоциации уксусной кислоты и ее галогенпроизводных, других карбоновых кислот и т.п., были получены несколько странные значения констант диссоциации HCl, NaCl и т.д. Это и понятно, если единственной причиной отличия 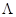 от
от 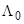 считать неполную диссоциацию электролита.
считать неполную диссоциацию электролита.
Впоследствии, вследствие создания так называемой «теории сильных электролитов» – теории Дебая–Хюккеля – стало ясно, что межионные взаимодействия и в отсутствие ассоциации приводят к снижению значений 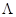 по сравнению с
по сравнению с 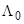 .
.
Поэтому первоначально классификация электролитов заключалась в делении их на «сильные» и слабые. В то время как последние подчиняются закон действия масс (ЗДМ), к сильным электролитам он неприменим, так как в воде они диссоциируют нацело или практически нацело. К ним относятся многие минеральные кислоты (HCl, HBr, HI, HNO3, H2SO4 (по первой ступени), HClO4), щелочи (NaOH, KOH) и многие соли.
Впрочем, некоторые методы, например, спектроскопия комбинационного рассеяния света, позволяют оценить константы диссоциации «сильных» кислот (СМ БЕЛЛ см Covington). Например, существуют следующие оценки для констант диссоциации «сильных» кислот в воде: CH3SO3H: K > 1, HNO3: K = 25, HCl: K = 107.
Здесь нужно сказать о концентрированных растворах и все же о ЗДМ ?!
Ограниченность представлений о делении электролитов на сильные и слабые обнаружилась вскоре после начала систематических исследований ионных процессов в неводных растворах (П. Вальден, Ч. Краус, Р. Фуосс, Н. А. Измайлов). Действительно, оказалось, что многие электролиты, нацело диссоциирующие в воде (хлороводород, азотная и хлорная кислоты, многие соли), оказываются слабыми в неводных растворителях, где их поведение подчиняется закону действия масс.
Стало понятным, что сила электролита (понимаемая как способность диссоциировать на ионы) не является его постоянным свойством, а обусловлена также и свойствами растворителя.
Более рациональным является современное разделение электролитов на истинные (ионофоры) и псевдоэлектролиты (ионогены).
Ионофоры – это соединения, которые уже в конденсированном состоянии существуют в ионной форме. Другими словами, это соли, как неорганические (NaCl, K2SO4), так и органические, такие, как N(C2H5)4Pic.
Ионогены, напротив, образуют (генерируют) ионы лишь при контакте с растворителем. К ионогенам относятся, например, уксусная кислота, бензойная кислота, хлороводород.
Конечно, любая классификация ограничена, и со временем обнаружились исключения.[12]
Что происходит в растворах электролитов, каковы формы существования ионофоров и ионогенов в жидких средах? Для ответа на этот вопрос рассмотрим вначале наиболее общую картину для электролита CA, в духе схемы, предложенной впервые Измайловым. Сольватированная молекула ионогена (CA)solv претерпевает превращение в ионное соединение (C+A–)solv, которое может диссоциировать на свободные сольватированные ионы C+solv и A–solv, способные, в свою очередь, ассоциировать, образуя пару C+solv A–solv и сохраняя при этом полностью или частично свою сольватную оболочку.
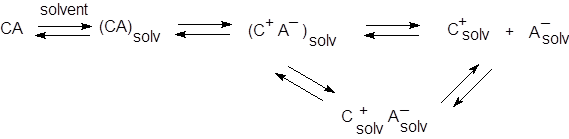
Схема Измайлова уже была рассмотрена в общем курсе физической химии; она может быть адаптирована для кислот, оснований и солей. В схеме Измайлова фигурируют равновесия сольватации, диссоциации, ассоциации и так называемого «превращения» (вторая стадия). Вводятся также и соответствующие константы:
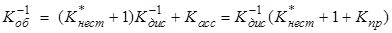 ,
, 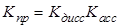 ,
,
Для солей (ионофоров) схема упрощается, так как изначально имеется ионное соединение (C+A–). Заметим, что термин «ионизация» Измайловым не использовался.
Часто термины диссоциация и ионизация рассматривают как синонимы. Например, мы часто говорим о константе равновесия распада уксусной, бензойной или другой слабой кислоты на ионы в водном растворе либо как о константе диссоциации, либо как о константе ионизации.
Существуют несколько иные терминологии. Например, при рассмотрении равновесий в органических растворителях ионизацией часто называют превращение нейтральной молекулы в пару ионов, связанных друг с другом, а диссоциацией – распад такой пары на ионы. Приводимый ниже пример показывает также, что разные методы исследования дают информацию о различных сторонах процесса. При растворении трифенилхлорметана в жидком SO2 (0 оС) имеют место следующие превращения (Вальден, Лихтин):
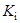
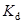
(C6H5)3C–Cl  (C6H5)3C+Cl–
(C6H5)3C+Cl–  (C6H5)3C+ + Cl–
(C6H5)3C+ + Cl–
бесцветное желтый цвет желтый цвет
соединение
Первую ступень часто называют ионизацией, а вторую – диссоциацией. Для возникновения окраски не нужно полной диссоциации на свободные ионы, нужен лишь разрыв связи C–Cl, ведущий к образованию желтого трифенилкарбониевого иона; sp3–гибридизация узлового атома углерода переходит в sp2–гибридизацию. Поэтому спектрофотометрические измерения могут в принципе дать отношение равновесных концентраций:
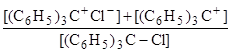
В то же время, кондуктометрический метод, основанный на измерении электропроводимости, дает «общую» (over-all) константу, по Измайлову – «обычную» константу равновесия:
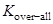 =
= 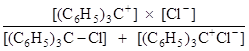 .
.
Нетрудно показать, что:
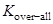 =
= 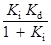
Для рассматриваемой системы при 0 оС: 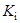 = 1.46
= 1.46 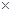 10–2,
10–2, 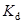 = 2.88
= 2.88 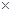 10–3 М,
10–3 М, 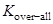 = 4.1
= 4.1 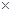 10–5 М.
10–5 М.
Само по себе превращение молекул (C6H5)3C–Cl в ионы тоже происходит за счет ассоциации аниона хлора, в этом случае – с молекулами растворителя, ввиду сильно выраженной способности молекулы SO2 (являющейся кислотой Льюиса) служить акцептором электронной пары. Это пример специфической сольватации.
Добавление к раствору LiClO4 приводит к убыли нейтральных молекул (C6H5)3C–Cl. Причиной является образование устойчивого ассоциата LiCl, или, точнее, Li+Cl–. По принципу ле-Шателье происходит сдвиг равновесия вправо.
В некоторых малополярных НДВС растворителях, например, в 1,2-дихлорбензоле, прибавление хлороводорода к раствору (C6H5)3C–Cl ведет к стабилизации ионной пары (C6H5)3C+Cl– за счет образования продукта (C6H5)3C+Cl– ··· H–Cl.
Рассмотрим вначале типичные ионофоры, т. е. соли. Для того, чтобы избежать разночтений, связанных с терминами ионизация и диссоциация, Фуосс предложил говорить об ассоциации ионов и о константах ассоциации, 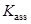 . Таким образом, исходным состоянием ионофора считается существование в виде отдельных ионов в растворе. Уравнение ЗДМ будет выглядеть следующим образом:
. Таким образом, исходным состоянием ионофора считается существование в виде отдельных ионов в растворе. Уравнение ЗДМ будет выглядеть следующим образом:
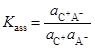
Мы рассматриваем здесь так называемые 1 : 1 электролиты, состоящие из однозарядного катиона и однозарядного аниона. В принципе, возможны и другие варианты, например: La(ClO4)3, [N(C2H5)4]2SO4, MgSO4 и так далее.
Т а б л и ц а 11
Кристаллографические радиусы ионов
| Ион | Кристаллографический радиус, пм |
| Li+ | |
| Na+ | |
| K+ | |
| Rb+ | |
| Cs+ | |
| NH4+ | |
| N(CH3)4+ | |
| N(C2H5)4+ | |
| N(н-C4H9)4+ | |
| As(C6H5)4+ | |
| F– | |
| HO– | |
| Cl– | |
| Br– | |
| I– | |
| ClO4– | |
| Пикрат | |
| B(C6H5)4– |
1 пм = 10–12 м = 10–3 нм = 102 Å
Размер иона и характер сольватации
Дать рисунок – на выбор несколько простых ионов – см Карапетьянц и Дракин
Ион в растворителе
Ко-сфера Герни
Поскольку наиболее естественным методом оценки диссоциации электролита (или ассоциация соответствующих ионов с противоположными знаками заряда) является измерение электропроводимости раствора, критерием образования ионного двойника (ионной пары) C+A–, не вносящего вклад в перенос электрического тока, является равенство энергии притяжения (по закону Кулона) и энергии теплового движения. Первым соответствующее выражение дал В. Семенченко (1923-1924):
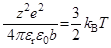
Несколькими годами позднее Н. Бьеррум предложил выражение того же типа:
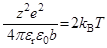 ,
,
и основании таких соотношений теоретически оценил константу катион-анионной ассоциации. Так, например, подтвердилось, что в воде ( 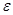 около 80) для 1 : 1 электролитов ассоциация несущественна, т. е. одно лишь кулоновское взаимодействие практически не дает ионных пар, и мы имеем в этом случае «сильные электролиты», например, хлорид натрия.
около 80) для 1 : 1 электролитов ассоциация несущественна, т. е. одно лишь кулоновское взаимодействие практически не дает ионных пар, и мы имеем в этом случае «сильные электролиты», например, хлорид натрия.
Параметр b есть то минимальное расстояние, начиная с которого катион и анион участвуют в тепловом движении уже вместе. Нетрудно рассчитать, что для 1:1 электролита при 25 оС справедливо выражение: b = 28.026 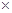
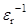 (нм).
(нм).
Здесь, правда, следует заметить, что при средних и низких значениях 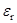 значение b уже может составлять несколько нанометров, и такая пара ионов уже не является химическим соединением (комплексом, ассоциатом) в обычном смысле.
значение b уже может составлять несколько нанометров, и такая пара ионов уже не является химическим соединением (комплексом, ассоциатом) в обычном смысле.
В каких случаях нужно считаться с ионными парами? Разумным критерием является значение степени диссоциации электролита, 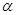 , для средних концентраций электролита, например, 0.001–0.01 М.
, для средних концентраций электролита, например, 0.001–0.01 М.
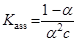
Простые оценки показывают, что если константа 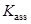 < 103 М–1, то в первом приближении электролит можно считать диссоциированным на ионы.
< 103 М–1, то в первом приближении электролит можно считать диссоциированным на ионы.
Во взаимодействии ионов, в частности, в ассоциации ионов противоположного знака существенную роль играет значение 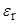 растворителя. В таблице 7 представлены значения константы ассоциации катиона тетра-н-бутиламмония с анионом пикрата: N(н-C4H9)4+ + C6H2(NO2)3O–
растворителя. В таблице 7 представлены значения константы ассоциации катиона тетра-н-бутиламмония с анионом пикрата: N(н-C4H9)4+ + C6H2(NO2)3O–  ионная пара. Выбор катиона и аниона объясняется тем, что это – крупные ионы с сильно делокализованным зарядом, и специфические взаимодействия друг с другом, могущие усилить ассоциацию независимо от значения
ионная пара. Выбор катиона и аниона объясняется тем, что это – крупные ионы с сильно делокализованным зарядом, и специфические взаимодействия друг с другом, могущие усилить ассоциацию независимо от значения 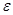 растворителя, сведены к минимуму.
растворителя, сведены к минимуму.
Такие константы ассоциации обычно определяют методом электропроводимости. [13]
Т а б л и ц а 7
Значения константы ассоциации {N(н-C4H9)4+ + C6H2(NO2)3O–  ионная пара} в различных растворителях (25 oC)
ионная пара} в различных растворителях (25 oC)
| Растворитель | 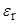
| 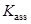 , М–1 , М–1
|
| Ацетонитрил | 35.94 | |
| Метанол | 32.66 | |
| Ацетон | 20.56 | |
| Нитрометан | 35.87 | |
| Метилизобутилкетон | 12.92 | 2.0 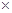 103 103
|
| 1,2-Дихлорэтан | 10.23 | 3.2 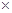 103 103
|
| 1,3-Дихлорбензол | 9.93 | 5.9 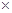 104 104
|
| н-Бутилацетат | 5.10 | 1.2 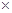 107 107
|
Это откорректировать на основе наших данных и расчетов
Роль диэлектрической проницаемости и специфика растворителя
Теория Бренстеда, основанная на уравнении Борна
Модель Борна: «заряженный шарик в диэлектрическом континууме».
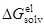 = –
= – 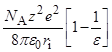
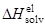 = –
= – 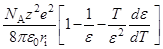
Пример линейной зависимости 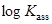 от
от 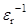
 |
Перхлорат тетраметиламмония в различных растворителях (слева направо): в нитробензоле, бензонитриле, ацетоне, 2-бутаноне, пиридине:
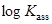 = 0.765 + 33.46
= 0.765 + 33.46 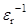 , r = 0.99
, r = 0.99
(по данным P.C. Ho, J.B. Ramsey. J. Chem. Eng. Data 1986. Vol. 31. No. 4. P. 430-434.)
Некулоновские взаимодействия
Специфические и универсальные среды, по Фиалкову
В таблице 8 даны ориентировочные границы значений 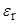 , соответствующие преобладающим формам существования ионофора (свободные ионы, ионные пары, тройники, димеры ионных пар и др.) при средних концентрациях, например, около 10–3 М. При этом речь идёт прежде всего об ионах, не склонных к специфическим взаимодействиям друг с другом и с молекулами растворителя. Такими ионами могут быть тетраалкиламмониевые катионы, тетрафениларсоний и тетрафенилфосфоний, с одной стороны, и пикрат, тетрафенилборат, а также тетраалкилборатные анионы.
, соответствующие преобладающим формам существования ионофора (свободные ионы, ионные пары, тройники, димеры ионных пар и др.) при средних концентрациях, например, около 10–3 М. При этом речь идёт прежде всего об ионах, не склонных к специфическим взаимодействиям друг с другом и с молекулами растворителя. Такими ионами могут быть тетраалкиламмониевые катионы, тетрафениларсоний и тетрафенилфосфоний, с одной стороны, и пикрат, тетрафенилборат, а также тетраалкилборатные анионы.
Т а б л и ц а 8
Преобладающие частицы в растворах ионофора C+A– в зависимости от значения относительной диэлектрической проницаемости 1
Значение 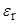
| Пример растворителя | Частицы в растворах |
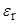 > 40 > 40
| Пропиленкарбонат, формамид, ДМСО | C+ и A– |
40 > 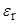 > 20 > 20
| Ацетонитрил, нитрометан, ДМФА, метанол, этанол, ацетон | Главным образом C+ и A–, некоторое количество C+A– |
20 > 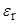 > 10 > 10
| 1-Бутанол, 1,2-дихлорэтан метилизобутилкетон, | Главным образом C+A– и некоторое количество C+ и A– |
10 > 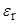 > 5 > 5
| 1-Октанол, тетрагидрофуран, этилацетат, хлорбензол | Главным образом C+A– и небольшое количество C+ и A–; возможны частицы C+A–C+ и A–C+A–, а также (C+A–)2 |
5 > 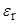 > 2 > 2
| Трихлорметан, анизол, 1, 4-диоксан, бензол | C+A–, возможно: C+A–C+ и A–C+A–, а также более крупные агрегаты: (C+A–)n |
1 Оценки сделаны главным образом на основании кондуктометрических данных.
О тройниках – Фуосс и Краус
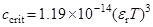 ; при 25 оС:
; при 25 оС: 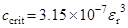
О причинах образования тройников и квадруполей.
Образование тройников и форма фореограммы
В малополярных растворителях, например, в бензоле ( 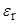 = 2.3) или н-гексане (
= 2.3) или н-гексане ( 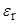 = 1.9), ввиду сильных кулоновских взаимодействий свободных ионов практически нет. При этом возможно образование не только ионных пар C+A– (двойников, диполей) и тройников C+A–C+, A–C+A–, но также и димеров ионных пар (квадруполей) (C+A–)2 и более крупных агрегатов (C+A–)n. Так, в подобных растворителях тиоцианат тетра-н-бутиламмония при концентрациях порядка 0.5 М может образовывать частицы со степенью агрегации около 30 (по данным криоскопии). Фактически, это уже зародыши новой фазы.
= 1.9), ввиду сильных кулоновских взаимодействий свободных ионов практически нет. При этом возможно образование не только ионных пар C+A– (двойников, диполей) и тройников C+A–C+, A–C+A–, но также и димеров ионных пар (квадруполей) (C+A–)2 и более крупных агрегатов (C+A–)n. Так, в подобных растворителях тиоцианат тетра-н-бутиламмония при концентрациях порядка 0.5 М может образовывать частицы со степенью агрегации около 30 (по данным криоскопии). Фактически, это уже зародыши новой фазы.
До сих пор речь шла главным образом о влиянии относительной диэлектрической проницаемости на ассоциацию ионов. Но важную роль в этом процессе играют также специфические взаимодействия как ионов с растворителем (сольватация), так и ионов между собой (водородные связи, образование комплексов с переносом заряда). В отличие от рассмотренных выше ионов тетрабутиламмония, пикрата и подобных им, малые по размеру ионы и ионы, могущие участвовать в образовании водородных связей способны вести себя довольно специфически. Примером может служить аномально высокая устойчивость ассоциатов аниона пикрата с катионами аммония и щелочных металлов, особенно с ионом лития, в нитробензоле (Таблица 9).
Т а б л и ц а 9
Значения констант ассоциации аниона пикрата C6H2(NO2)3O– с различными катионами C+ в нитробензоле ( 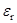 = 35.7)
= 35.7)
| Катион C+ | 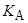  10–3, М–1 10–3, М–1
|
| Li+ | |
| Na+ | |
| K+ | 0.014 |
| (CH3)4N+ | 0.025 |
| (C2H5)4N+ | 0.0071 |
| (н-C4H9)4N+ | 0.0075 |
| (н-C4H9)3NH+ | 5.3 |
| (н-C4H9)2NH2+ | 6.4 |
| (н-C4H9)NH3+ | 6.6 |
| NH4+ | 6.9 |
(Робинсон и Стокс) Ч. Краус, Р. Фуосс и их сотрудники
В случае тетраэтил- и тетраметиламмониевых ионов плотность положительного заряда на атомах водорода мала, и подобные взаимодействия крайне слабы.
В случае катионов щелочных металлов взаимодействие сильное, так как они слабо сольватированы в нитробензоле, этом протофобном и катионофобном растворителе (см. значения донорных чисел Гутмана). Хуже всего сольватирован в данном случае ион лития, который в силу своего малого радиуса создает вокруг себя электростатическое поле высокой напряженности.
Причина заключается в образовании водородной связи в случае иона аммония:
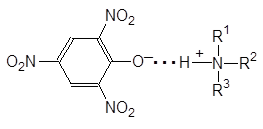
По данным М. Ходжо с сотр., 1991 [14]
25 оС
| Растворитель |  (н-C4H9)4N+ + SCN– (н-C4H9)3NH+ + SCN–
(н-C4H9)4N+ + SCN– (н-C4H9)3NH+ + SCN–
| |
| Ацетонитрил | 0.98 | 2.65 |
| Бензонитрил | 1.84 | 3.95 |
| Нитробензол | 1.39 | 3.99 |
| Нитрометан | 0.28 | 3.08 |
Другой пример, приводимый ниже, призван показать роль сольватации катиона как фактора, конкурирующего с комплексообразованием. В таблице 10 представлены значения логарифмов констант комплексообразования катионов натрия и калия с макроциклическим лигандом 18-краун-6:
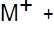
| 
|

| 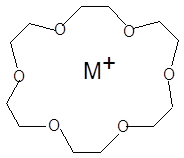
|
Т а б л и ц а 10
Значения логарифмов констант устойчивости комплексов катионов щелочных металлов с 18-краун-6 в различных растворителях при 25 оС
| Растворитель | lgKуст Na+ K+ | |
| Протофобные (катионофобные): | ||
| Ацетон | 4.46 | 5.89 |
| Ацетонитрил | 4.6 | 5.76 |
| Протофильные (катионофильные): | ||
| N,N-Диметилформамид | 2.5 | 4.2 |
| Диметилсульфоксид | 1.43 | 3.25 |
Более устойчивы комплексы катионов металлов с криптандами. Так, при взаимодействии ионов Na+ и K+с криптандом 2.2.2
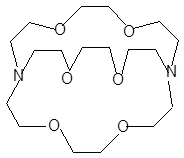
в ДМФА lgKуст = 5.83 и 7.89, а в ДМСО соответственно 5.2 и 7.0. И в этом случае в протофобных растворителях значения выше; например, в ацетонитриле для тех же катионов щелочных металлов lgKуст = 10.68 и 10.46.
Множественность ионных пар
До сих пор мы не делали различия между ассоциатами двух типов, (C+A–)solv и (C+solv A–solv), хотя в общей схеме диссоциации электролитов, предложенной Измайловым, предусмотрены были оба типа ассоциатов.
В начале 1950-х годов накопилось много опытного материала, в том числе и по кинетике некоторых реакций, свидетельствующего о том, что ионные пары могут быть по крайней мере двух типов. В 1954 году это было отмечено практически одновременно Уинстейном, Грюнвальдом и Фуоссом.
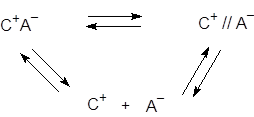
(при этом все частицы сольватированы).
| контактные | сольватно-разделенные |
| короткие | длинные |
| по терминологии ИЮПАК: | |
| тесные (tight) | рыхлые (loose) |
Различают также «проникнутые» (penetrated) ионные пары
Химические последствия образования ионных пар (Лупи, Чубар, и т.п.)
Акри (см Белецкая (Усп. химии), Arnett – или Bordwell)
Поведение ионогенов. ??!
Дата добавления: 2014-12-09; просмотров: 3692;
