В растворах при 298 К
| Концентрация, моль/1000г Н2О | Коэффициент активности для электролитов | ||||||
| NaCl | KCl | NaOH | KOH | HCl | H2SO4 | CaCl2 | |
| 0,001 0,01 0,1 0,5 1,0 2,0 5,0 | 0,965 0,874 0,778 0,681 0,657 0,668 0,874 | 0,966 0,901 0,769 0,651 0,607 0,576 - | 0,966 0,900 0,776 0,693 0,679 0,700 1,060 | 0,966 0,900 0,766 0,712 0,735 0,683 1,670 | 0,966 0,904 0,796 0,758 0,809 1,010 2,380 | 0,830 0,544 0,265 0,156 0,132 0,128 0,208 | 0,840 0,580 0,518 0,448 0,500 0,792 0,890 |
Как видно из табл. 18 коэффициенты активности меняются в очень широких пределах: в области разбавленных растворов они стремятся к единице, в то время как в области высококонцентрированных растворов они могут достигать единиц, десятков и даже сотен. В области разбавленных растворов (ниже 0,1 моль/л) коэффициенты активности зависят главным образом от концентрации и заряда ионов, присутствующих в растворе, и мало зависят от природы растворенных веществ. Эта закономерность известна в теории растворов иод названием правила ионной силы. Согласно этому правилу, ионы одинаковой зарядности, независимо от их природы, в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионной силой раствора называется полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда:
I = 0,5 Σ cizi2 (3)
Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы растворов и заряда ионов.
Коэффициенты активности позволяют, используя простейшие соотношения, быстро и легко рассчитать реальные свойства растворов. Для расчета константы равновесия любого обратимого процесса, протекающего в растворе, вместо концентраций используются соответствующие активности. Так, для обратимого процесса
AnBm ↔ nAm+ + mBn –
отражающего, например, диссоциацию слабого электролита в растворе в присутствии сильного электролита, константа равновесия будет равна:
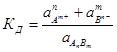
Итак, поведение растворов слабых электролитов описывается законом Оствальда, а разбавленных растворов сильных электролитов - моделью ионной атмосферы Дебая — Хюккеля. Однако общая теория растворов электролитов, охватывающая все виды растворов электролитов и весь диапазон концентраций, до сих пор не создана.
7.3.4. Ионное произведение воды. Водородный показатель.Водаявляется слабым электролитом. Процесс диссоциации воды может быть записан с помощью уравнения:
Н2О + Н2О ↔ Н3О+ + ОН –
Этот процесс называется самоионизацией или автопротолизом.
Реакцию диссоциации воды часто записывают в более простом виде:
Н2О ↔ Н+ + ОН –
[Н+][ОН –]
 КД =
КД =
[Н2О] (4)
Учитывая, что при комнатной температуре на ионы распадается лишь одна из примерно 108 молекул воды, активности ионов в уравнении могут быть заменены их концентрациями, а концентрацию нераспавшихся молекул воды можно считать равной общей концентрации молекул воды. Концентрацию молекул можно рассчитать, разделив массу 1 л воды на массу ее моля:
1000/18 = 55,5 моль/л
Считая эту величину постоянной, можно уравнение (4) записать в виде:
[Н+][ОН –] = КД 55,5 = КВ (5)
где КВ — ионное произведение воды.
Так как, в соответствии с уравнением диссоциации, концентрации ионов Н+ и ОН – в воде одинаковы, их можно определить, зная ионное произведение воды. При 295 К ионное произведение воды равно 10 – 14 . Отсюда
[Н+] = [ОН –] = 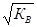 = 10 – 7 моль/л (6)
= 10 – 7 моль/л (6)
B соответствии с теорией электролитической диссоциации, ионы Н+ являются носителями кислотных свойств, а ионы ОН – — носителями основных свойств. Поэтому раствор будет нейтральным, когда ан+ = аон- = 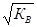 ; кислым, когда ан+ > аон- , и щелочным, когда ан+ < аон- .
; кислым, когда ан+ > аон- , и щелочным, когда ан+ < аон- .
Для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель, или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе:
pH = -lgaH+ (7)
Водородный показатель определяет характер реакции раствора.
Например, при 295 К она нейтральна; при рН = 7 (ан+ = 10–7 моль/л). При
рН < 7 (ан+ > 10–7 моль/л), реакция раствора кислая, при рН > 7
(ан+< 10–7 моль/л) – щелочная. По известным значениям активности ионов Н+ рассчитать можно активность ионов ОН – :
аон- = КВ / ан+ (8)
По аналогии рН введен показатель рОН:
pOH = -lg аон- (9)
и показатель рКВ,равный
рКВ = -lgКВ (10)
Из уравнений (3 - 7) следует:
рКВ= pH + рОН (11)
Таким образом, зная рОН, можно легко рассчитать рН, и наоборот, по известному значению рН легко определяется рОН. Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы Н+ и ОН- непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Так, рН 0,1 М растворов уксусной и соляной кислот будут 2,87 и 1,088 соответственно. Для оснований подобная зависимость имеет обратный характер.
Водородный показатель играет важную роль в жизнедеятельности
организма. Так, в норме рН сыворотки крови равен 7,40 ± 0,05, слез -
7,4 ± 0,1, слюны - 6,35 ÷ 6,85, желудочного сока - 0,9 ÷ 1,1. Отклонение рН от нормальных значений приводит к расстройству деятельности организма. Существенно влияние на урожайность оказывает рН почвы, на экологию водоема - рН воды.
Прирасчете рН слабых электролитов обычно принимают, что ан+ ≈ [Н+]. В этом случае
PH ≈ -lg [Н+]. (12)
Концентрация ионов водорода в растворе слабых кислот определяют по уравнениям Оствальда (1) или (2), (2а, б)
[h+] = ас= 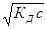
Аналогично определяют концентрацию ионов гидроксида:
[OH – ] = ac = 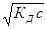
значения рН в этом случае находят по уравнению (11).
Пример 1.Определите концентрацию ионов ОН – в 0,01 М NH4OH. Рассчитайте рН этого раствора при 295 К.
Решение. Гидроксид аммония - слабый электролит и диссоциирует обратимо: NH4OH ↔ NH4+ + ОН –. В соответствии с законом Оствальда степень диссоциации а равна:
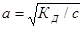
Подставляя значение КД, получаем:
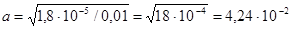
Равновесная концентрация ионов ОН – равна:
[ОН– ] = ас = 4,24 ∙10– 2 ∙ 10– 2 = 4,24 ∙ 10 – 4 моль/л.
Водородный показатель равен:
рН = рКВ - рОН
Можно считать, что в растворе слабого электролита активность ионов равна их концентрации. Тогда
рОН = -lg [ОН–] = -lg 4,24 ∙ 10 – 4 = 3,37
Соответственно рН = 14 - 3,37 = 10,63
Расчет рН сильной кислоты проводят по уравнениям (7), (9) и (11). Для этого необходимо определить ионную силу по уравнению (3) и коэффициент активности ионов водорода или гидроксида по табл. 18.
Пример 2. Рассчитайте рН раствора, содержащего 0,01 моль/л НС1 и 0,01 моль/л СаС12.
Решение. Так как НС1 и СаС12 сильные электролиты, то они диссоциируют полностью:
НС1 → Н+ + С1– , CaCl2 →Са2+ + 2С1–
Соответственно рН раствора определяем по формуле:
рН = -1g ан+= -1gγн+[н+]
Для расчета коэффициента активности необходимо определить ионную силу раствора:
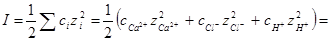 1/2[0,01∙4+(0,02+0,01)12+0,01∙12] = 0,04
1/2[0,01∙4+(0,02+0,01)12+0,01∙12] = 0,04
На На основании табл. 18 путем интерполяции находим γн+ = 0,86, следовательно,
pH = -lg (0,86 ∙ 0,01) = 2,07
7.4. Гидролиз солей. Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодисcоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды, называется гидролизом.
Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КС1. Гидролиз соли, образованной слабой кислотой и сильным основанием, например CH3COONa. Соль в растворе полностью диссоциирует на ионы:
CH3COONa → СН3СОО – + Na+
Вода, как уже указывалось, является слабым электролитом:
Н2О ↔ Н+ + ОН –
Ионы водорода воды взаимодействуют с ацетат-ионами с образованием слабой уксусной кислоты
СН3СОО – + Н+↔ СН3СООН
Таким образом, гидролиз в ионной форме можно представит уравнением
СН3СОО – + Н2О ↔СН3СООН + ОН –
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной, следовательно, при гидролизе соли, образованной сильным основанием и слабой кислотой, происходит увеличение рН системы, т. е. среда становится основной (происходит подщелачивание раствора).
Показателем глубины протекания гидролиза является степень гидролиза β, представляющая собой отношение концентрации гидролизованных молекул сгидр к исходной концентрации растворенных молекул электролита:
β = сгидр/с
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации сиона = аиона, запишем константу равновесия реакции гидролиза:
[СН3СООН][ОН –]
 Кс =
Кс =
[СН3СОО –][Н2О]
или в общем виде для реакции гидролиза аниона слабой кислоты
А- + Н2О ↔НА + ОН –
[НА][ОН –]
 Кс =
Кс =
[А –][Н2О]
Так как концентрация воды при гидролизе изменяется очень мало, то принимаем ее постоянной и, умножая на константу равновесия, получим константу гидролиза Кr:
[НА][ОН –]
 Кс[Н2О] = Кr =
Кс[Н2О] = Кr =
[А –]
Умножая числитель и знаменатель на равновесную концентрацию ионов водорода, получаем
[НА][ОН-][Н+]
 Кr =
Кr =
[А-][Н+]
Как указывалось ранее, [OH –][ Н+] ≈ КВ, а отношение - [Н+][А-] / [НА]
является константой диссоциации КД слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Кr = КВ / КД
Если выразить концентрацию ионов и молекул при установлении равновесия
СН3СОО – + Н2О ↔ СН3СООН + ОН –
через степень гидролиза β и исходную концентрацию иона с, то получаем, что
[СН3СООН] = [ОН –] = βс, а [СН3СОО –] = (1 - β)с
Подставив эти значения в уравнение
[НА][ОН–]
 Кr =
Кr =
[А–]
получим:
Кr = КВ/КД = β2с / ( 1 - β).
Если β « 1,то
Кr = β2с
Отсюда следует, что
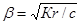
Как видно, степень гидролиза возрастает с уменьшением концентрации гидролизующегося иона. По уравнению Кr = β2с можно найти равновесную концентрацию гидроксид-иона:
[ОН-] = βс = 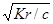
и рОН = -lg[OH-] = -lg 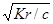 = - lg
= - lg 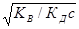
Отсюда легко вычисляется рН раствора соли
рН = рКВ - рОН = рКВ -lg 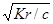
Если гидролизу подвергается многоосновной анион, то гидролиз протекает по стадиям:
СО32- + Н2О↔НСО3– +ОН –
НСО3 – + Н2О ↔ Н2СО3 + ОН–
Константа гидролиза по первой ступени значительно выше, чем константа гидролиза по последней ступени. Например, для гидролиза СО32 – , при 298 К
Кr1 = 2∙10 – 4 ; Кr2 = 2,2-10 – 8
Поэтому, при расчете концентраций ионов [ОН–] или [Н+], второй и третьей ступенью гидролиза обычно пренебрегают. Анализ уравнений гидролиза показывает, что в уравнении Кr = КВ / КД для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени.Например, константа гидролиза иона СО32- по первой ступени
СО32 - + Н2О↔ НСО3– + ОН –
равна
КВ 10 – 14

 Кr = = = 2 ∙10 – 4
Кr = = = 2 ∙10 – 4
КД,2 4,8 ∙10 – 11
а константа гидролиза иона РО43 – по первой ступени
РО43 – + Н2О↔НРО42 – + ОН-
равна
КВ 10 – 14

 Кr = = = 7,7 ∙10 –3
Кr = = = 7,7 ∙10 –3
КД,3 7,3 ∙10 – 12
Гидролиз солей, образованных сильной кислотой и слабым основанием, напримерNH4C1. В растворе соль NH4Cl диссоциирована
NH4C1 → NH4+ + С1 –
Гидролизу подвергается ион слабого основания NH4+
NH4+ + Н2О↔NH4OH + H+
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т. е. среда подкисляется. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора.
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями, но лишь с включением константы диссоциации слабого основания.
Равновесную концентрацию ионов водорода можно вычислить из уравнения:
[Н+] = βс = 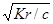
Соответственно водородный показатель среды рассчитывается по уравнению:
РН = -1g[Н+] = - 1g 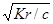 = -1g
= -1g 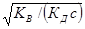
Гидролиз соли, образованной слабым основанием и слабой кислотой, напримерNH4F
NH4F → NH4+ + f-
NH4+ + H2O↔NH4OH + H+
F - + Н2О↔ HF + OH –
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания КД,О,так и слабой кислоты КД,К
КВ
 Кr =
Кr =
КД,К КД,О
Степень гидролиза и концентрация ионов водорода в этом случае не зависят от исходной концентрации соли:
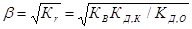
[H+] = 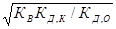
рН= 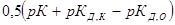
Как видно, в зависимости от соотношения рКД,К и рКД,О среда может иметь как кислую, так и основную реакцию.
Гидролиз играет важную роль в природных и технологических процессах. Например, расщепление пищи в желудочно-кишечном тракте идет по реакции гидролиза ее компонентов. Энергия в организмах в основном переносится с помощью аденозинтрифосфата (АТФ), гидролиз которого характеризуется отрицательным значением энергии Гиббса (-30,5 кДж/моль).
Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы K+ и анионы CN-. Катионы K+ не могут связывать ионы ОН- воды, так как КОН — сильный электролит. Анионы же CN- связывают ионы H+ воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CN – + H2O ↔ HCN + OH –
или в молекулярной форме
KCN + H2O↔ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор KCN имеет щелочную реакцию( рН > 7).
Таблица 19
Дата добавления: 2014-12-26; просмотров: 3347;
