Автоионизация растворителей и строение иона лиония в растворах
Автоионизация:
В простейшем случае предполагается схема:
2HL  H2L+ + L–;
H2L+ + L–; 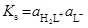
примеры:
спирты: 2ROH  ROH2+ + RO–
ROH2+ + RO–
аммиак: 2NH3  NH4+ + NH2–
NH4+ + NH2–
ДМСО: 2(CH3)2SO  (CH3)2SOH+ + CH3SOCH2–.
(CH3)2SOH+ + CH3SOCH2–.
уксусная кислота: 2CH3COOH  CH3COOH2+ + CH3COO–
CH3COOH2+ + CH3COO–
уксусный ангидрид – два механизма
и в других случаях картина может быть сложнее
Значения 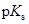 некоторых растворителей (25 оС)
некоторых растворителей (25 оС)
| Растворитель | 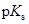
|
| Вода | 14.00 |
| Аммиак | 32.5 (–33 оС) |
| Уксусная кислота | 14.45 |
| Муравьиная кислота 1 | 6.2 |
| Серная кислота | 3.33 |
| Фтороводород | 12.5 (0 оС) |
| Уксусный ангидрид 2 |  14.5 (20 оС) 14.5 (20 оС)
|
| Метанол | 16.7-17.2 |
| Этанол | 18.9-19.5 |
| 1-Бутанол | 21.6 |
| трет-Бутанол | 26.8-28.5 |
| Формамид | 16.8 (20 оС) |
| Диметилформамид | 29.4 |
| Диметилсульфоксид | 33.3 |
| Ацетон | 32.5 |
| Ацетонитрил | 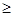 33.3 33.3
|
1 Имеются доводы в пользу того, что ион лиония муравьиной кислоты, HCOOH2+, разлагается на CO и H3O+, и именно ион гидроксония является ионом лиония в данном растворителе.
2 Молекула (CH3CO)2O диссоциирует, по всей вероятности, на ионы ацетилия CH3CO+ и ацетата CH3COO–.
даже для воды
Обычно в воде предполагают существование протона прежде всего в виде иона H3O+,
Цундель, Винник: H5O2+,
Эйген H9O4+,
Уэллс H11O5+,
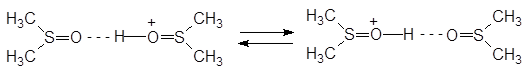
Стехиометрия может быть и сложнее, так, наиболее вероятным считается состав иона лиония H(DMSO)2+:

Но точнее, вероятно, так:
Автоионизация возможна и в растворителях, молекулы которых вообще не содержат атом водорода:
POCl3  POCl2+ + Cl–
POCl2+ + Cl–
(Гутман)
N2O4  NO+ + NO3–
NO+ + NO3–
Температура кипения 21.3 оС , 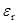 = 2.42 при 18 оС,
= 2.42 при 18 оС, 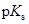
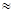 25
25
(Buvari – см)
Но в инертных малополярных растворителях, таких, как бензол или гексан, автоионизация вообще не происходит.
Особо – о роли воды.
Представление о пересольватации протона как о химической реакции
В простейшем случае:
H3O+ + СH3OH  СH3OH2+ + H2O
СH3OH2+ + H2O
H3O+ + (СH3)2SO  (СH3)2SOH+ + H2O
(СH3)2SOH+ + H2O
Отсюда – роль примесей воды в неводных растворителях и связь с основностью растворителей
Особенности кислотно-основных равновесий в растворителях различных групп
Дата добавления: 2014-12-09; просмотров: 3275;
