Протолитические равновесия в инертных растворителях
В бензоле из-за низкого значения диэлектрической проницаемости ( 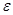 = 2.3) свободных ионов практически не существует. Соответственно теряет смысл и понятие pH и
= 2.3) свободных ионов практически не существует. Соответственно теряет смысл и понятие pH и 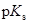 .
.
Кислота передает протон основанию непосредственно, а не через молекулу растворителя.
Кислотно-основные взаимодействия протекают по схеме:
B + HA  B ··· HA
B ··· HA  BH+ ··· –A
BH+ ··· –A
Основные методы исследования: молекулярная спектроскопия (ИК и электронная)
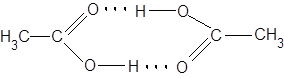
2 CH3COOH  (CH3COOH)2,
(CH3COOH)2, 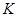 = (1.7–4.0)
= (1.7–4.0) 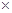 103;
103;
для бензойной и азотной кислот в бензоле: 2.3 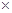 103 и 1.2
103 и 1.2 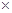 103, соответственно.
103, соответственно.
криоскопия, эбуллиоскопия, ИК-спектры
подобные димеры обнаруживаются даже в газовой фазе!
[2.1.1] криптанд и соответствующий криптат лития
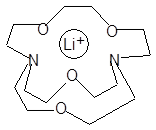 стандартная кислота HA0
стандартная кислота HA0
[LiL]+A0– + HA  [LiL]+A– + HA0
[LiL]+A– + HA0
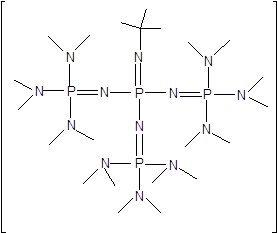
фосфазин
Бензол, гептан
Но в таких растворах по-прежнему вероятно образование ионных тройников, квадруполей и даже более крупных частиц
Переход от малополярного растворителя (ДП = 1.9) к вакууму, ДП = 1
Сравнение с вакуумом
Уравнения реакций в растворах обычно ради упрощения записывают без растворителя, остающегося при этом «за кадром» (за исключением случаев, когда молекула растворителя непосредственно участвует в химическом превращении).
Но, как еще в середине прошлого века настойчиво подчеркивал Измайлов, в растворе диссоциирует не сама кислота (или, в общем случае, электролит), а её сольватный комплекс с растворителем. Вообще, все реакции в растворах протекают между сольватированными частицами.[16] Это очевидное обстоятельство с особой силой напоминает о себе, когда речь заходит о протолитических свойствах соединений в газовой фазе. Здесь нарушаются привычные представления об относительной силе как кислот, так и оснований, сформировавшиеся на основании экспериментальных данных, полученных для растворов.
Так, уксусная кислота и фенол в газовой фазе, то есть в изолированном состоянии, оказываются практически одинаково сильными кислотами.
Одинаковыми по силе в газовой фазе оказываются бензойная кислота и толуол, хотя последний в растворах может отщеплять протон лишь в суперосновных средах.
PA = – 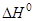 (A– + H+
(A– + H+  HA)
HA)
(B + H+  HB+)
HB+)
различные разновидности масс-спектрометрии
Ряд алкиламинов
См М.И. Кабачник. Успехи химии. 1979
Райхардт
Дата добавления: 2014-12-09; просмотров: 1561;
