ЭЛЕКТРОХИМИЧЕСКИЕ ЭЛЕМЕНТЫ В НЕВОДНЫХ СРЕДАХ
Стандартная цепь:
Pt (H2) | H+, Cl– | AgCl | Ag
Электродная реакция:
(1/2) H2 + AgCl 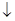
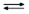 H+ + Cl– + Ag
H+ + Cl– + Ag 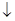
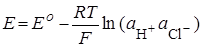
| Растворитель |  , мВ (298.15 К) , мВ (298.15 К)
|
| Вода | + 222.4 |
| Метанол | – 10.4 |
| Этанол | – 74.0 |
| Диметилсульфоксид | + 40.8 |
Значения  в различных растворителях по отношению к
в различных растворителях по отношению к  водородного электрода (H+|H2) в данном растворителе, принятом равным нулю (25 оС), определяют «ряд активности металлов» в данном растворителе.
водородного электрода (H+|H2) в данном растворителе, принятом равным нулю (25 оС), определяют «ряд активности металлов» в данном растворителе.
Но даже эта известная последовательность, хорошо нам знакомая для водных растворов, может несколько изменяться в неводных средах. Так, если в воде  (Cu+|Cu) = + 520 мВ и
(Cu+|Cu) = + 520 мВ и  (Cu2+|Cu) = + 340 мВ, то в ацетонитриле эти величины равны –360 и –260 мВ, соответственно.
(Cu2+|Cu) = + 340 мВ, то в ацетонитриле эти величины равны –360 и –260 мВ, соответственно.
В воде  (Pb2+|Pb) = –130 мВ, а в жидком аммиаке: + 320 мВ.
(Pb2+|Pb) = –130 мВ, а в жидком аммиаке: + 320 мВ.
Плотников – электролитическое получение алюминия
Редокс-процессы. Восстановление углеводородов, например, на РКЭ:
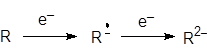
Полярные НДВС-растворители стабилизируют ион-радикалы, и разность потенциалов полуволн довольно большая
К тому же карбанионы в воде и в других гидроксилсодержащих растворителях менее устойчивы
Дата добавления: 2014-12-09; просмотров: 1584;
