Всякое физическое тело (система), поставленное в определённые внешние условия, рано или поздно приходит в состояние термодинамического (статистического) равновесия.
Это утверждение можно рассматривать как один из основных постулатов термодинамики и статистической физики.
Внешние условия характеризуются своими параметрами.
Наше тело (система) – внутренними параметрами. Эти параметры характеризуют свойства самой системы.
Внутренние параметры зависят от внешних параметров.
В состоянии термодинамического равновесия системы они имеют при заданных внешних параметрах и температуре (энергии) определённые численные значения.
Одна и та же величина, в зависимости от условий, в которых находится система, может играть роль как внешнего, так и внутреннего параметра.
Например. Если фиксировано положение стенок сосуда, объём является внешним параметром, а давление – внутренним. Если, однако, ограничить систему в сосуде подвижным поршнем под постоянной нагрузкой, то давление будет внешним параметром, а объём – внутренним параметром.
Итак, интуитивно считается очевидным, что если изолированную систему оставить в покое, то она в конце концов придёт в равновесие. Но каким образом это будет происходить – большой вопрос.
Если система поставлена в определённые внешние условия (то есть, заданы её внешние параметры), но она находится в неравновесном состоянии (то есть, её внутренние параметры не имеют равновесных значений), то система изменяется во времени, приближаясь к своему равновесному состоянию.
Процесс перехода термодинамической системы из неравновесного состояния в равновесное называется процессом релаксации. При этом для выравнивания значения каждого параметра по всему объёму системы существует свое характерное время релаксации – время релаксации для данного параметра. Роль полного времени релаксации играет, очевидно, максимальное из этих времён. Более подробно об этом мы поговорим когда будем изучать принципы неравновесной термодинамики.
А сейчас начнём обсуждать проблемы равновесной термодинамики.
Термодинамика представляет собой классический пример аксиоматически построенной науки. В основе её лежат несколько фундаментальных законов, которые являются обобщением нашего опыта и рассматриваются как аксиомы. В этом смысле термодинамика аналогична евклидовой геометрии.
Чтобы подчеркнуть аксиоматический характер основных законов термодинамики и их общность, о них говорят как о началах термодинамики. Обычно выделяют четыре начала термодинамики.
Четыре начала термодинамики в формулировке известного немецкого физика А.Зоммерфельда.
Нулевое начало (температура как функция состояния).
Существует функция состояния – температура. Равенство температур во всех точках есть условие равновесия двух систем или дух частей одной и той же системы.
Термодинамика занимается изучением свойств физических систем в состоянии равновесия. Любой вывод, приводящий к введению температуры, относится к термодинамическому равновесию. Поэтому температура определена только для состояний равновесия.
Температура выступает как мера средней энергии теплового движения молекул. Она связана со средней кинетической энергией частиц системы следующим выражением:
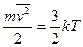 (1)
(1)
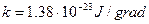 - постоянная Больцмана.
- постоянная Больцмана.
Из этого соотношения следует, что температура является функцией мгновенного распределения скоростей молекул, то есть функцией состояния системы. Она не зависит от предыстории системы и полностью определяется состоянием системы в данный момент времени.
Температура не единственная функция состояния. Любая физическая величина, имеющая определённое значение для каждого равновесного состояния системы, является функцией состояния и называется термодинамической величиной. К ним относятся, например, температура давление, внутренняя энергия и т.д.
Термодинамические величины или функции состояния – это тот язык, на котором разговаривает термодинамика.
Напомню, что основными понятиями классической механики являются координаты и импульсы составляющих её частиц.
Квантовая механика описывает процессы на языке волновых функций.
Работа и теплота в термодинамике не являются функциями состояния, а 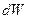 и
и 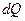 не есть полный дифференциал какой-либо функции состояния.
не есть полный дифференциал какой-либо функции состояния.
Первое начало термодинамики (закон сохранения энергии).
Каждая термодинамическая система обладает характеристической функцией состояния – энергией. Эта функция состояния возрастает на величину сообщённого системе тепла 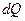 и уменьшается на величину совершённой системой внешней работы. Для изолированных систем справедлив закон сохранения энергии (справедлив независимо от того, находится ли система в равновесии или нет).
и уменьшается на величину совершённой системой внешней работы. Для изолированных систем справедлив закон сохранения энергии (справедлив независимо от того, находится ли система в равновесии или нет).
Первое начало термодинамики:
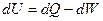
определяет новую функцию состояния – внутреннюю энергию U («эн» – ёмкость, «эрг» - «работа»). Под внутренней энергией подразумевается энергия системы, зависящая от её внутреннего состояния (энергия теплового движения всех микрочастиц системы и энергия их взаимодействия).
Кинетическая энергия движения системы как целого и её потенциальная энергия во внешних силовых полях во внутреннюю энергию не входят.
Тепло, полученное системой, идёт на приращение её внутренней энергии и на производство внешней работы.
Дата добавления: 2014-12-09; просмотров: 1433;
