Теплоёмкость.
Теплоёмкость тела С называется отношение бесконечно малого количества тепла 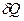 , полученного телом, к соответствующему приращению
, полученного телом, к соответствующему приращению 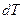 его температуры:
его температуры:
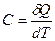 .
.
Когда масса тела равна единице, теплоёмкость называется удельной. Более удобна молярная теплоёмкость – теплоёмкость одного моля вещества.
Приращение температуры 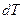 не определяет ещё полностью того бесконечно близкого состояния, в которое переходит система из заданного состояния.
не определяет ещё полностью того бесконечно близкого состояния, в которое переходит система из заданного состояния.
Рассмотрим, например, физически однородное тело, состояние которого полностью определяется двумя параметрами, в качестве которых можно взять объём и температуру.
Пусть исходное состояние изображается точкой 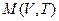 (см. рис.). Проведём прямую
(см. рис.). Проведём прямую 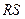 , параллельную оси объёмов и отстоящую от точки
, параллельную оси объёмов и отстоящую от точки 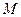 на величину
на величину 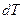 . Все точки этой прямой изображают состояния с одной и той же температурой
. Все точки этой прямой изображают состояния с одной и той же температурой 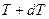 , но с различными объёмами. Система из состояния
, но с различными объёмами. Система из состояния 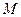 может перейти в различные близкие состояния
может перейти в различные близкие состояния 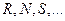 , лежащие на этой прямой. Всем этим переходам соответствует одно и то же повышение температуры, но, вообще говоря, различные количества тепла
, лежащие на этой прямой. Всем этим переходам соответствует одно и то же повышение температуры, но, вообще говоря, различные количества тепла 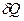 . Будут разными и теплоёмкости системы при таких переходах.
. Будут разными и теплоёмкости системы при таких переходах.
Поэтому теплоёмкость есть характеристика не одного какого-либо состояния системы, а двух бесконечно близких состояний её, из которых одно является начальным, а другое конечным.
Вместо двух бесконечно близких состояний можно задать одно из них и направление пути перехода системы в бесконечно близкое состояние.
Таким образом, теплоёмкость не есть функция состояния тела, а является характеристикой бесконечно малого процесса, совершаемого телом.
Придадим этим рассуждениям количественную форму.
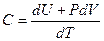
Так как
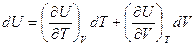
то
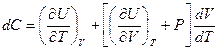
Объём 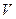 зависит не только от температуры
зависит не только от температуры 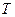 , но и от даления
, но и от даления 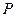 . В зависимости от того как меняется давление, отношение
. В зависимости от того как меняется давление, отношение 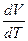 может принять любое значение. Чтобы придать этому выражению однозначный смысл, надо фиксировать значение этого отношения. Иными словами, надо указать в плоскости
может принять любое значение. Чтобы придать этому выражению однозначный смысл, надо фиксировать значение этого отношения. Иными словами, надо указать в плоскости 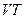 направление пути, по которому система переходит в бесконечно близкое состояние.
направление пути, по которому система переходит в бесконечно близкое состояние.
Так как это направление может быть любым, то теплоёмкость 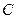 , вообще говоря, может принимать любые значения от
, вообще говоря, может принимать любые значения от 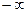 до
до 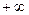 . В частности:
. В частности:
для изотермического процесса 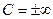 , так как в этом случае
, так как в этом случае 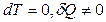 .
.
для адиабатического процесса 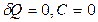 .
.
Особое значение имеют теплоёмкости при постоянном объёме (изохорная теплоёмкость 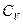 ) и постоянном давлении (изобарная теплоёмкость
) и постоянном давлении (изобарная теплоёмкость 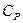 ).
).
Если объём остаётся постоянным, то 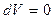 , и следовательно,
, и следовательно,
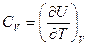 .
.
Если процесс протекает при постоянном давлении, то на основании определения энтальпии 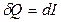 . Поэтому
. Поэтому
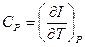
В фундаментальное уравнение термодинамики для закрытых систем 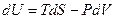 входят пять переменных
входят пять переменных 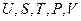 . Три величины
. Три величины 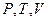 можно измерить. Независимыми параметрами могут быть любые два из перечисленных пяти переменных, поэтому возможно записать целый ряд термодинамических функций состояния двух независимых переменных:
можно измерить. Независимыми параметрами могут быть любые два из перечисленных пяти переменных, поэтому возможно записать целый ряд термодинамических функций состояния двух независимых переменных: 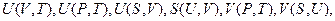 и т.д.
и т.д.
В термодинамике чаще применяют для описания системы характеристическиефункции.
Функция состояния системы двух независимых параметров называется характеристической, если посредством этой функции и её производных по этим параметрам могут быть выражены все термодинамические свойства системы.
Например, функция 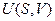 – характеристическая.
– характеристическая. 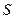 и
и 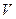 являются независимыми параметрами, а
являются независимыми параметрами, а 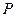 и
и 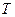 определятся на основе уравнения
определятся на основе уравнения 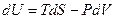 (*).
(*).
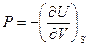 ,
, 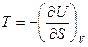
А величина энтальпии определится из соотношения
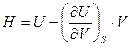
Можно легко убедиться, что такие функции, как 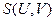 и
и 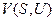 также являются характеристическими. Можно записать ещё целый ряд характеристических функций, но обычно в термодинамике чаще всего используются четыре:
также являются характеристическими. Можно записать ещё целый ряд характеристических функций, но обычно в термодинамике чаще всего используются четыре:
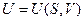 ,
,
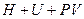 , (**)
, (**)
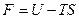 ,
,
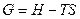 .
.
Используя формулы (*) и (**) запишем дифференциалы этих функций и определим стандартные переменныесоответствующих характеристических функций:
Энтальпия Н.
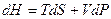 ,
,
Дата добавления: 2014-12-09; просмотров: 2401;
