Всякое физическое тело (система), поставленное в определённые внешние условия, рано или поздно приходит в состояние термодинамического (статистического) равновесия.
Если система поставлена в определённые внешние условия (то есть, заданы её внешние параметры), но она находится в неравновесном состоянии (то есть её внутренние параметры не имеют равновесных значений), то система изменяется во времени, приближаясь к своему равновесному состоянию.
Нередко бывает, что скорость изменения внутреннего параметра 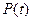 пропорциональна его отклонению от равновесного значения
пропорциональна его отклонению от равновесного значения 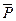 ; в этом случае
; в этом случае
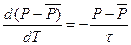 , (2)
, (2)
где 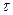 - постоянный множитель, называемый временем релаксации.
- постоянный множитель, называемый временем релаксации.
Интегрируя это выражение, получим
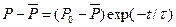 (3)
(3)
Здесь 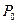 - неравновесное значение параметра
- неравновесное значение параметра 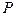 в начальный момент времени
в начальный момент времени 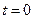 .
.
Из соотношения (3) видно, что 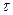 - время, в течение которого отклонение параметра от его равновесного значения уменьшается в
- время, в течение которого отклонение параметра от его равновесного значения уменьшается в 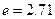 раза. Время релаксации
раза. Время релаксации 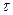 зависит не только от природы внутреннего параметра
зависит не только от природы внутреннего параметра 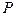 , но и от характера нарушения его равновесного значения. Например, если
, но и от характера нарушения его равновесного значения. Например, если 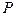 давление в данной точке внутри газа, то
давление в данной точке внутри газа, то 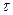 , связанное с нарушением равновесного распределения молекул по скоростям, - другое.
, связанное с нарушением равновесного распределения молекул по скоростям, - другое.
В силу этого зависимость 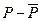 от времени может быть более сложной, чем (3); так, например,
от времени может быть более сложной, чем (3); так, например, 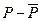 может равняться сумме экспоненциальных членов с разными временами релаксации
может равняться сумме экспоненциальных членов с разными временами релаксации 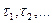 . Возможен и такой случай, когда зависимость
. Возможен и такой случай, когда зависимость 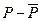 от времени имеет характер затухающих колебаний.
от времени имеет характер затухающих колебаний.
Если в системе реализуется термодинамическое равновесие только в отношении части переменных, описывающих систему, то говорят о неполном термодинамическом равновесии.
Величина времени релаксации может меняться в очень широких пределах.
Например, при нарушении равновесного распределения молекул газа по скорости время релаксации для давления имеет порядок среднего времени между двумя последовательными столкновениями молекул; для газа, находящегося при нормальных условиях ( 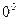 Цельсия и атмосферное давление), это время
Цельсия и атмосферное давление), это время 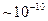 сек. С другой стороны, обычное стекло представляет собой аморфное тело, не находящееся в состоянии термодинамического равновесия. Известно, что в течение длительных промежутков времени, измеряемых годами и даже десятками лет, аморфное стекло переходит в равновесное кристаллическое состояние. В этом случае
сек. С другой стороны, обычное стекло представляет собой аморфное тело, не находящееся в состоянии термодинамического равновесия. Известно, что в течение длительных промежутков времени, измеряемых годами и даже десятками лет, аморфное стекло переходит в равновесное кристаллическое состояние. В этом случае 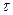 порядка десятков лет, то есть примерно в
порядка десятков лет, то есть примерно в 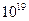 раз больше, чем в предыдущем случае. В случае стекла имеет место своеобразная ситуация, когда в системе осуществляется статистическое равновесие молекул по скоростям, но не имеет места равновесие по положениям молекул в пространстве.
раз больше, чем в предыдущем случае. В случае стекла имеет место своеобразная ситуация, когда в системе осуществляется статистическое равновесие молекул по скоростям, но не имеет места равновесие по положениям молекул в пространстве.
Уравнение состояния идеального газа имеет вид.
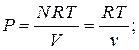
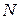 - полное число молей в газе;
- полное число молей в газе; 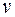 - объем одного моля;
- объем одного моля; 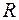 - универсальная газовая постоянная. Соответственно, зависимость давления от объема при этих температурах близка к гиперболе.
- универсальная газовая постоянная. Соответственно, зависимость давления от объема при этих температурах близка к гиперболе.
Реальный газ. Вириальное уравнение состояния. Уравнение Ван – дер - Ваальса.
Для реальных газов термическое уравнение состояния 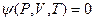 в общем виде записывается так
в общем виде записывается так
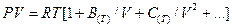 ,
,
где 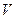 – мольный объём газа;
– мольный объём газа; 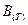 ,
, 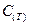 , … - второй, третий и т.д. вириальные коэффициенты. Само уравнение называется вириальным уравнением состояния(Каммерлинг – Онесс).
, … - второй, третий и т.д. вириальные коэффициенты. Само уравнение называется вириальным уравнением состояния(Каммерлинг – Онесс).
Принципиально можно теоретически рассчитать вириальные коэффициенты с той или иной степенью точности. Но это довольно сложная проблема, которая в конце курса ещё будет затронута.
Вычислив 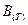 ,
, 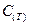 , …, получим уравнение состояния для конкретного газа.
, …, получим уравнение состояния для конкретного газа.
Лучше было бы получить уравнение состояния, которое описывало поведение всех реальных газов, несмотря на потери в точности.
Впервые эту задачу решил голландский физик Ван-дер-Ваальс в своей диссертации "Непрерывность газообразного и жидкого состояния" (1873 г.). Такое уравнение состояния должно учитывать взаимодействие молекул, т.е. силы притяжения и отталкивания между молекулами.
Простые и не очень строгие рассуждения привели к уравнению вида
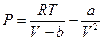 или
или 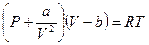 (*)
(*)
Уравнение называется уравнением состояния Ван-дер-Ваальса.Вывод сделан на основе качественных рассуждений о молекулярном объёме "b" и межмолекулярных силах притяжения, величина которых пропорциональна квадрату плотности газа. Но в этом и сила этого подхода. Не надо точно знать, что происходит между молекулами. К величинам "а" и "b" можно относиться как к подгоночным параметрам. А сходство реальных изотерм в Р, V – диаграмме с изотермами Ван-дер-Ваальса говорит о силе этого уравнения.
Постижение движущей силы
Проблема моделирования состояния вещества в метастабильной области сводится к определению способа продолжения различных термодинамических линий (изохор, изотерм, изобар) за пограничную кривую. Из того, что известно о метастабильных состояниях, можно ожидать плавного, без каких либо особенностей, изменения термодинамических параметров при постепенном углублении в «чужую» область (например, перегреве жидкости).
Рассматривая в качестве движущей силы системы в точке A разность потенциала Гиббса метастабильного и равновесного состояний системы, необходимо придумать способ продолжения вышеуказанных термодинамических линий в метастабильную область за кривую MN. При этом предполагается, что равновесные термодинамические параметры системы известны.
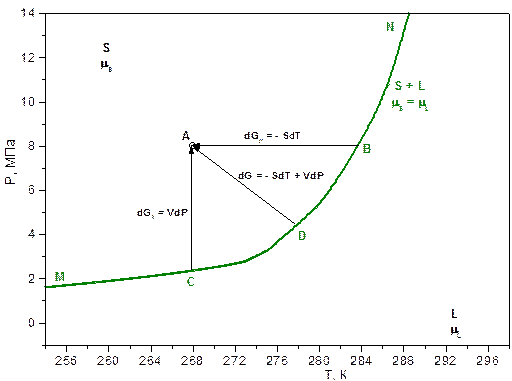
Однокомпонентная жидкость.
Вычислим энергию Гиббса однокомпонентного вещества в точке А (метастабильной жидкости и твёрдого тела).
Для однокомпонентной жидкости термодинамический потенциал Гиббса является характеристической функцией с параметрами 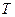 и
и 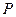 .
.
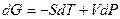 (1)
(1)
На кривой MN в равновесии находятся твёрдая и жидкая фазы. В точках B,C и D химические потенциалы (парциальные мольные энергии Гиббса) компонентов твёрдой и жидкой фаз равны: 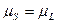 . Исследуем три случая.
. Исследуем три случая.
1. Изобарический: 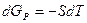 .
.
Для метастабильной жидкости:
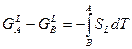 (2)
(2)
Для твёрдого тела:
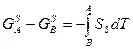 (3)
(3)
Объединяя (2) и (3) получаем:
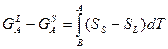 (4)
(4)
Фазовые превращения, вообще говоря, сопровождаются скачкообразными изменениями энтропии. Это означает, что при таких превращениях поглощается или выделяется тепло. Например, при переходе единицы массы вещества из газообразного состояния 1 в жидкое 2 выделяется тепло
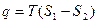 (5)
(5)
При обратном переходе из жидкого состояния 2 в газообразное 1 такое же тепло поглощается. Предполагается, что переход совершается квазистатически при постоянной температуре, а, следовательно, и при постоянном давлении. Тепло 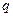 называется удельной теплотой испарения. В общем случае оно называется удельной теплотой фазового превращения. Например, говорят о теплоте плавления, теплоте возгонки и пр.
называется удельной теплотой испарения. В общем случае оно называется удельной теплотой фазового превращения. Например, говорят о теплоте плавления, теплоте возгонки и пр.
Первое приближение.
Подставляя (5) в (4) получаем:
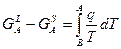 (6)
(6)
Продолжение соотношений (5) и (6) в метастабильную область.
2. Изотермический: 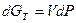 .
.
Для метастабильной жидкости:
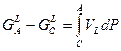 (7)
(7)
Для твёрдого тела:
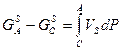 (8)
(8)
Объединяя (2) и (3) получаем:
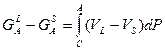 (9)
(9)
Первое приближение.
3. Общий: 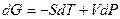 .
.
Для метастабильной жидкости:
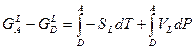 (10)
(10)
Для твёрдого тела:
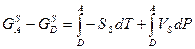 (11)
(11)
Объединяя (2) и (3) получаем:
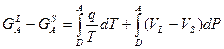 (12)
(12)
Продолжение соотношения (12) в метастабильную область.
Первое приближение.
1. M.Folmer. Kinetik der Phasenbildung. Dresden – Leipzig. 1939.
2. Н. Дас Гупта, С. Гош. Камера Вильсона и её применения в физике. ИЛ, М. 1947.
3. В.И. Данилов. Строение и кристаллизация жидкости. Изд. АН УССР. Киев. 1956.
4. Д. Хирс, Г. Паунд. Испарение и конденсация. Изд. «Металлургия», М. 1966.
5. А.Г. Амелин. Теоретические основыобразования тумана при конденсации пара. Изд. «Химия». М. 1966.
6. Б. Чалмерс. Теория затвердевания. Изд. «Металлургия», М. 1968.
в обзорных статьях:
7. Д.Н. Холломон. Д. Тарнбалл. Успехи физики металлов. т.1. Металлургиздат. М., 1956. стр. 304.
17. J. Feder, K.C. Russell, J.Lothe, G.M.Pond. Adv. Phys., 15, №57, 111, (1966).
18. Debenedetti, P.G., Metastable Liquids, Concepts and Principles, Princeton University Press, NJ (1996).
19. Debenedetti, P.G., J. Phys.: Condens. Matter, 15, R1669 (2003).
Всякое физическое тело (система), поставленное в определённые внешние условия, рано или поздно приходит в состояние термодинамического (статистического) равновесия.
Для равновесной системы справедливо правило фаз Гиббса. которое записывается в следующем виде:
F = K – Ф + 2,
где К – число компонентов в системе, Ф – число фаз.
Кстати, для системы в пористых средах:
F = K – Ф + 3,
то есть система имеет на одну степень свободы больше по сравнению со свободным объёмом. Возможно формирование дополнительной фазы в пористой среде.
F = 0 – нонвариантная система, F = 1 – моновариантная система, F = 0 – бивариантная система, и т.д.
Фазовое поведение смесей углеводород + вода значительно отличается от фазового поведения смесей нормальных углеводородов (об их фазовом поведении мы будем говорить в курсе теории фазовых переходов …). Различия возникают от двух эффектов, каждый из которых проистекает от водородных связей.
Первый, фаза гидрата покрывает значительную часть всех фазовых диаграмм углеводород + вода для углеводородов с молекулярным размером меньшим 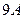 .
.
Второй, молекулы воды и углеводородов настолько различны, что в конденсированном состоянии образуются две жидкие различные фазы, каждый компонент которой очень мало растворим в другой фазе.
Дата добавления: 2014-12-09; просмотров: 1515;
